Лазерная хирургия варикозной болезни

Введение
Глава 1. Исторические вехи в лечении хронических заболеваний вен нижних конечностей (ХЗВНК) (Совместно с Т.В.Хлевтовой).
- 2.1. Эмбриогенез вен нижних конечностей
- 2.2. Анатомия венозной системы нижних конечностей.
- 2.3. Физиология венозного оттока из нижних конечностей
Глава 3. Современный взгляд на проблемы патогенеза варикозного расширения вен нижних конечностей.
Глава 4. Механизмы воздействия лазерного излучения на венозный комплекс (Совместно с Т.В.Хлевтовой).
- 5.1 Анатомические варианты и патофизиология сафено-феморального соустья и бассейна большой подкожной вены
- 5.2 Анатомическая классификация вариантов строения и патологических рефлюксов в системе малой подкожной вены
- 5.3. Анатомия и пути распространения рефлюксов крови в латеральной венозной системе
Глава 6. Эндовенозная лазерная облитерация в лечении варикозной болезни.
- 6.1 Краткая характеристика клинических наблюдений
- 6.2 Показания и противопоказания к ЭВЛО
- 6.3 Техника проведения ЭВЛО
- 6.4 Ошибки, опасности и осложнения при проведении ЭВЛО
Введение
Согласно результатам многочисленных эпидемиологических исследований, хронические заболевания вен нижних конечностей занимают лидирующие позиции среди хирургической патологии сосудов.
Создание специализированных флебологических центров и постоянный поиск новых методов лечения варикозной болезни остается задачей современной ангиологии. Предотвращение осложнений и рецидива заболевания после оперативного лечения, улучшение качества жизни и работоспособности пациентов является одним из важнейших направлений клинической флебологии, включающей поиск новых способов лечения пациентов с данной патологией.
Особый интерес к флебологии вообще, и хирургической флебологии в частности, развился и утвердился в последние десятилетия, на современном этапе развития и внедрения эндоваскулярных технологий.
Прошло уже 10 лет с момента появления первых сообщений об успешном применении эндовенозной лазерной облитерации (ЭВЛО) в лечении варикозной болезни. Основы технологии ЭВЛО заложены благодаря работам таких известных исследователей и популяризаторов этого метода, как T.M. Proebstle (ФРГ), R.J. Min (США), L. Navarro (США) и др. Практически с момента появления, методика ЭВЛО получает своё распространение в лечебных учреждениях России (Г.И.Назаренко, 2001; В.В.Кунгурцев, 2001; А.И. Шиманко, М.Д.Дибиров, 2004;
Ю.Л.Шевченко, Ю.М.Стойко, К.В.Лядов, А.Л.Соколов, 2005;
А.И.Кириенко, 2006; О.Н.Гужков, 2008 и др.).
Главным импульсом к возрастанию интереса к теоретическим и практическим разделам флебологии послужило раскрытие в последние годы многофакторных физиологических механизмов нарушений тканевого метаболизма и эндотелиальной дисфункции, лежащих в основе развития хронических заболеваний вен. Неотъемлемым приоритетом в оценке применения инновационных технологий, в частности ЭВЛО, является изучение функциональной и клинической анатомии, как важнейших составляющих факторов для выбора адекватной хирургической коррекции с использованием ЭВЛО.
Между тем время не стоит на месте, и накопление нового клинического и экспериментального материала заставляет пересматривать многие ранее казавшиеся незыблемыми аспекты. Прежде всего, это неснижаемый уровень неудовлетворительных результатов, достигающий 15% (N.M.Khilnani en al, 2010). Одной из причин этого является неадекватный выбор энергии, выделяемой по всей длине вены или на отдельных её участках в ходе проведения лазерной облитерации, недостаточная осведомленность практических врачей о вариантах распространения рефлюксов, а также ряд других факторов, которые необходимо учитывать в ходе выполнения ЭВЛО.
Представленная в работе новая анатомическая классификация вариантов венозной системы нижних конечностей и патологического рефлюкса при варикозной болезни позволила обосновать тактическую схему выбора рациональных способов выполнения ЭВЛО в каждом конкретном случае. Накопленный в Пироговском Центре опыт применения ЭВЛО, с учетом разработанных в клинике критериев, наметил конкретные направления повышения эффективности ЭВЛО.
Мы осознаём, что не все задачи, которые входили в программу исследований, полностью решены, да и вряд ли возможно их решить с исчерпывающей полнотой за какой-то конкретный период времени. Надеемся, что наша монография найдёт сторонников, и мы с благодарностью примем все пожелания и предложения, касающиеся обсуждаемой проблемы.
Глава 1. Исторические вехи в лечении хронических заболеваний вен нижних конечностей (ХЗВНК) (Совместно с Т.В.Хлевтовой).
Варикозное расширение вен нижних конечностей сопровождает человечество на протяжении всей его истории. Упоминания об этой болезни можно найти и в Ветхом Завете, и у византийских авторов.
Если патология вен нижних конечностей действительно является расплатой за прямохождение, то вполне возможно, что с ХЗВНК столкнулись уже предки современного человека. Первым прямоходящим предком человека был афарский австралопитек, живший около 4 миллионов лет назад на берегах озера Виктория в восточной Африке. Изучение скелета австралопитека даёт право утверждать, что человек произошел от этого двуногого животного. Страдало ли оно ХЗВНК? Неизвестно.
 Постепенно эволюционируя, на Земле появляется Человек разумный. Согласно исследованиям известного отечественного палеопатолога Д.Г.Рохлина, в период мезолита, т.е. от 15 до 6 тысяч лет до нашей эры, 30,8% людей умирали в возрасте от 0 до 14 лет, 6,1% – в возрасте от 15 до 20 лет, 58,6% – в возрасте от 21 до 40 лет, 3% – в возрасте от 41 до 60 лет и 1,5% – старше 61 года. Иными словами многие из них, кто доживал до среднего возраста, возможно, страдали ХЗВНК. Беспомощность перед силами природы заставляли людей того времени прибегать к заклинаниям и другим магическим приёмам, чтобы установить контакт с потусторонними силами и найти исцеление. “Лечение” проводили шаманы и колдуны. К сожалению, до нас не дошли сведения о приёмах, используемых в лечении ХЗВНК в те времена, но не вызывает сомнений, что они существовали.
Постепенно эволюционируя, на Земле появляется Человек разумный. Согласно исследованиям известного отечественного палеопатолога Д.Г.Рохлина, в период мезолита, т.е. от 15 до 6 тысяч лет до нашей эры, 30,8% людей умирали в возрасте от 0 до 14 лет, 6,1% – в возрасте от 15 до 20 лет, 58,6% – в возрасте от 21 до 40 лет, 3% – в возрасте от 41 до 60 лет и 1,5% – старше 61 года. Иными словами многие из них, кто доживал до среднего возраста, возможно, страдали ХЗВНК. Беспомощность перед силами природы заставляли людей того времени прибегать к заклинаниям и другим магическим приёмам, чтобы установить контакт с потусторонними силами и найти исцеление. “Лечение” проводили шаманы и колдуны. К сожалению, до нас не дошли сведения о приёмах, используемых в лечении ХЗВНК в те времена, но не вызывает сомнений, что они существовали.
Развитие рабовладельческого строя, пришедшего на смену первобытно-общинному, привело к скачку в развитии медицины. Возникает письменность, а вслед за ней – возможность изучать опыт других людей. Первые дошедшие до нас описания сосудов человеческого тела с подразделением их на артерии и вены относятся к V-VI векам до нашей эры и принадлежат Диогену из Апполонии и Эврифону Книдскому. Несмотря на некоторые познания в анатомии, врачи античности не знали о циркуляции крови. По их мнению, кровь двигалась только по венам, а в артериях циркулировал воздух. Венозные и артериальные кровеносные сосуды они представляли как две самостоятельные системы, не соединенные между собой. Это обосновывалось тем, что при вскрытии трупов людей и животных в венах была кровь, а артерии были пустые. Данное убеждение было опровергнуто только в начале новой эры, в результате трудов римского исследователя и врача Клавдия Галена (130—200 гг.). Он экспериментально показал, что кровь движется сердцем и по артериям, и по венам, и вплотную подошёл к открытию кровообращения. После Галена вплоть до XVII века считали, что кровь из правого предсердия попадает в левое какимто образом через перегородку.
 После упадка Римской империи в Европе на долгие столетия опустился занавес Средневековья. И только с Эпохой Возрождения возвращается естественно-научный подход к изучению природы и человека.
После упадка Римской империи в Европе на долгие столетия опустился занавес Средневековья. И только с Эпохой Возрождения возвращается естественно-научный подход к изучению природы и человека.
В 1628 г. Уильям Гарвей публикует концепцию большого круга кровообращения в труде «Extercitato anatomica de motu cordis et sanguinus in animalibus».
Интересно отметить, что хотя приоритет открытия кровообращения во всём мире признан за У.Гарвеем, в китайском трактате «Хуанди нэйцзин», написанном в VI веке до н.э., т.е. за 19 веков до У.Гарвея, вопросы кровообращения и кровеносных сосудов освещены с такой прозорливостью, что с некоторыми издержками звучат вполне современно. В частности, там говорится, что: «кровь, транспортируя газы ян-ци и инь-ци и питательные вещества, находится в сосудах. Сосуды сообщаются между собой по кругу. В нём нет начала и конца».
 В 1691 г. Marcello Malpighi открывает капиллярную сеть между артериями и венами.
В 1691 г. Marcello Malpighi открывает капиллярную сеть между артериями и венами.
В своих исследованиях Мальпиги одним из первых использовал микроскоп, дававший увеличение до 180 раз. Его именем названы некоторые открытые им органы и структуры: мальпигиевы тельца (в почках и селезёнке), мальпигиев слой (в коже), мальпигиевы сосуды (у паукообразных, многоножек и насекомых).
Взаимосвязь патологии клапанов с развитием варикозной болезни будет отмече-
на гораздо позднее в работах G.Richter (1799) и Tommaso Rima (1836).
 В 1704 году Antonio Maria Valsalva (1666—1723) впервые описал нагрузочную пробу, используемую в отоларингологии при среднем гнойном отите. До настоящего времени проба Вальсальвы лежит в основе многих функциональных флебологических тестов.
В 1704 году Antonio Maria Valsalva (1666—1723) впервые описал нагрузочную пробу, используемую в отоларингологии при среднем гнойном отите. До настоящего времени проба Вальсальвы лежит в основе многих функциональных флебологических тестов.
В 1803 году появляется первое описание перфорантных вен Ю.Х.Лодером, который разделил их на прямые, которые соединяют основные стволы подкожных вен с глубокими венами, и непрямые, обеспечивающие связь притоков подкожных вен с глубокими венами. Ю.Х. Лодеру медицинский факультет Московского университета обязан одним из лучших в Европе анатомических театров.
Ю.Х. Лодеру медицинский факультет Московского университета обязан одним из лучших в Европе анатомических театров.
Впервые наличие венозного рефлюкса в подкожных венах при варикозной болезни продемонстрировал Benjamin Brodie (1846). Им было показано, что наложение жгута на бедро дистальнее сафенофеморального соустья препятствует рефлюксу крови, что явилось обоснованием необходимости хирургической перевязки и пересечения большой подкожной вены в лечении варикозной болезни. Позже в 1896 году Perthes рекомендует жгутовую пробу для выявления несостоятельности клапанов БПВ.
 Весь этот период явился предтечей современного патофизиологически обоснованного лечения варикозного расширения вен нижних конечностей. К середине XIX века было накоплено достаточно знаний по анатомии и физиологии венозной системы, однако развитие хирургического лечения было невозможно вследствие отсутствия адекватного анестезиологического пособия.
Весь этот период явился предтечей современного патофизиологически обоснованного лечения варикозного расширения вен нижних конечностей. К середине XIX века было накоплено достаточно знаний по анатомии и физиологии венозной системы, однако развитие хирургического лечения было невозможно вследствие отсутствия адекватного анестезиологического пособия.
 18 октября 1846 года считается отправной точкой развития современной хирургии. В этот день William P.Morton впервые применил эфирный наркоз. С появлением методов общего обезболивания стало возможным осуществлять более активную хирургическую тактику лечения ХЗВНК.
18 октября 1846 года считается отправной точкой развития современной хирургии. В этот день William P.Morton впервые применил эфирный наркоз. С появлением методов общего обезболивания стало возможным осуществлять более активную хирургическую тактику лечения ХЗВНК.
Считая причиной варикозной болезни наличие рефлюкса через сафено-феморальное соустье, Fridrich von Trendelenburg в 1860 году предложил выполнять через поперечный разрез в верхней трети бедра лигирование и пересечение большой подкожной вены.

Алексей Алексеевич Троянов (1848—1916) для диагностики недостаточности клапанов БПВ использовал пробу, аналогичную пробе Тренделенбургу, а для лечения варикозной болезни рекомендовал применять двойную лигатуру большой подкожной вены «с вырезыванием». Оба автора не настаивали на необходимости лигирования БПВ на уровне сафено-феморального соустья, что  обуславливало в те времена появление большого количества рецидивов. А. Троянов первым в России выполнил перевязку большой подкожной вены при варикозной болезни в 1888 г, а в мае 1890 года на заседании врачей Обуховской больницы продемонстрировал двух больных, прооперированных по новому методу.
обуславливало в те времена появление большого количества рецидивов. А. Троянов первым в России выполнил перевязку большой подкожной вены при варикозной болезни в 1888 г, а в мае 1890 года на заседании врачей Обуховской больницы продемонстрировал двух больных, прооперированных по новому методу.
Кроме перевязки БПВ, т.е. устранения источника рефлюкса крови, вскоре была осознана необходимость устранения путей его распространения. В 1884 году Madelung представляет свою концепцию тотальной экстирпации БПВ через длинные разрезы кожи по линии её проекции. Операция, несмотря на её «патофизиологичность», была травматичной и поэтому нуждалась в усовершенствовании. В 1906 году C.Mayo сообщил об удалении БПВ из нескольких коротких разрезов, а также о применении экстравазального кольцевого венэкстрактора – vein stripper. Дистальный конец пересеченной вены продевался в кольцо, фиксировался, и путём продвижения кольца книзу вдоль вены достигалось «вырезание» вены из окружающих тканей. В 1905 году Keller описал инвагинационное удаление БПВ. В просвет БПВ вводилась витая проволока и фиксировалась к вене. При потягивании за проволоку вена выворачивалась и удалялась.
 W.Babcock в 1907 году опубликовал результаты удаления БПВ с помощью зонда собственной конструкции. Именно этот зонд стал прототипом большинства современных инструментов для удаления БПВ, метод удаления вены на зонде получил названия по имени его автора.
W.Babcock в 1907 году опубликовал результаты удаления БПВ с помощью зонда собственной конструкции. Именно этот зонд стал прототипом большинства современных инструментов для удаления БПВ, метод удаления вены на зонде получил названия по имени его автора.
Значительное число рецидивов и отсутствие возможности точного топического определения источников и путей распространения рефлюксов подталкивало к гиперрадикальности хирургических вмешательств. На рубеже XIX—XX веков существующие операции по удалению магистральных подкожных вен были дополнены чрезвычайно травматичными циркулярными или спиралевидными глубокими (до мышечной фасции) разрезами тканей бедра и голени по N.Schede (1877, 1893), Wenzel, Rindfleisch (1908), с целью пересечения всех подкожных вен.
Операция Rindfleish и её результаты (1908)
Cчиталось, что вторичное заживление таких ран приведёт к образованию плотных рубцов, препятствующих восстановлению поверхностных вен. В сегментах между рубцами в остатках вен должен был возникнуть тромбоз с последующей их облитерацией. Поэтому у подвергшихся данному вмешательству больных старались искусственно вызвать нагноение ран. Тяжелые последствия этих операций из-за обширных рубцов, повреждения нервов, артерий и лимфатических путей привели к быстрому и полному отказу от них. Кроме этого, даже после этих суперрадикальных операций отмечались рецидивы.
Предложенный W.W.Babcock метод удаления БПВ (МПВ) быстро вошёл в практику и на долгие годы стал «золотым стандартом» в лечении варикозной болезни вен нижних конечностей. Использование металлического зонда было простым и эффективным. Это был и первый шаг на пути к миниинвазивности.
В 1910 году М.М.Дитерихс предложил обязательную перевязку всех проксимальных притоков БПВ, для чего применял дугообразный разрез на 2 см выше паховой складки, спускающийся на бедро, широко открывающий область овальной ямки и позволяющий резецировать большую подкожную вену и её притоки.
Осмысление патологической роли пораженных перфорантных вен начинается с работ R.Linton, 1938—1953 гг. R.Linton патогенетически обосновал целесообразность разобщения поверхностной и глубокой венозных систем нижних конечностей при ПТБ и указал на возможность удаления поверхностных вен, которые ранее считались единственными путями компенсации венозного оттока при поражении глубоких вен.
Важно отметить, что к тому времени сформировались основные представления о патогенезе хронической венозной недостаточности, которые и послужили фундаментом для развития хирургии вен. Таким образом, прошло уже более полувека, с тех пор как были сформулированы основные принципы хирургического лечения ВРВНК, остающиеся актуальными до сих пор.
Следующий этап развития хирурги вен был обусловлен разработкой и внедрением рентгенологических методов диагностики. Этот новый метод диагностики позволил на несколько ином уровне взглянуть на патогенетические механизмы нарушения венозного возврата в нижних конечностях.
С 60-х гг. XX века флебография становится практически повсеместным исследованием при подозрении на венозную патологию нижних конечностей. Широкое внедрение этого метода исследования в клиническую практику обусловило значительный прогресс в хирургии хронической венозной недостаточности нижних конечностей. Благодаря флебографии стало возможным оценивать регионарные нарушения венозного оттока и на этой основе планировать хирургические вмешательства. Рентгеноконтрастная флебография без преувеличения явилась фундаментом, на котором произошло становление и развитие реконструктивной хирургии вен. В хирургическом лечении варикозной болезни к концу этого периода, своего рода стандартом стали: операция ТрояноваТренделенбурга, удаление ствола БПВ (МПВ) по Бэбкоку, надфасциальная перевязка перфорантных вен по Кокетту или их субфасциальная перевязка по Линтону, удаление варикозно расширенных притоков по Нарату.
Сохраняющийся высокий процент рецидивов после операций по поводу варикозной болезни, неудовлетворённость от этих вмешательств при хронической венозной недостаточности и частое выявление рефлюкса по глубоким венам по данным флебографий придало импульс к появлению и развитию хирургических вмешательств на глубоких венах.
Для усиления деятельности мышечного насоса голени при первичном варикозном расширении вен Askar (1965) предложил производить ушивание глубокой фасции по задней поверхности голени, а при ПТБ производил фасциотомию по задней поверхности верхней трети голени.
А.В. Покровский с соавт. (1986) модифицировали операцию субфасциальной перевязки коммуникантных вен, дополнив её одновременным ушиванием краев рассеченной фасции в виде дупликатуры.
С целью ликвидации рефлюкса крови из глубоких вен голени и улучшения дренажной функции «мышечно-венозной помпы» голени А.Н.Веденским в 1975 году была предложена надлодыжечная резекция задних большеберцовых вен на протяжении 5-6 см.
А.Н.Веденским в 1988 году была внедрена оригинальная методика дистанционной окклюзии задних большеберцовых вен. Она позволяет ликвидировать ретроградный кровоток как по надлодыжечным перфорантам, так и по реканализованным берцовым венам, тем самым ограничивая распространение гипертензии в зону трофических расстройств. В 1980 году В.С. Савельевым предложен комплекс оперативных вмешательств при ПТБ, объединенных общим названием – операция разобщения. С внедрением в клиническую практику этих вмешательств, создались предпосылки к проведению лечения посттромботической болезни, в свете профилактики тяжелых трофических расстройств.
Основателем реконструктивной хирургии вен по праву можно считать уругвайского хирурга E.Palma. В 1958 году им был предложен способ шунтирования при односторонних окклюзиях подвздошных вен, путем перемещения большой подкожной вены здоровой конечности на противоположную сторону и соединением её дистального конца с бедренной веной ниже участка окклюзии. Техника наложения шунта в поперечном положении, в проекции путей естественной компенсации оттока крови по коллатералям, приводила к улучшению состояния больной конечности. Однако, первые результаты показали, что послеоперационный период часто осложнялся тромбозами, не обеспечивая надежность и долговременность функционирования шунта, что стало приводить к воздержанию от таких операций.
Предотвращение тромбоза шунта было достигнуто принципиально новыми подходами: формирование шунта достаточного диаметра (не менее 7 мм), создание градиента давления путем перевязки вен, обеспечивающих коллатеральный отток на больной конечности, снижение травматичности и продолжительности основного вмешательства, ранняя активизация больных и раннее назначение антикоагулянтов (А.Н. Веденский и соавт.,1998).
В 1954 г R. Warren, T. Thayer впервые сообщили о реконструктивной операции при окклюзии бедренной вены. У семи пациентов было выполнено шунтирование с формированием анастомоза между подколенной и БПВ и перемещения последней в межмышечное пространство под глубокую фасцию. В 1970 г. E. Husni модифицировал эту операцию, оставив БПВ in situ.
Стремление к восстановлению клапанной функции реканализованных глубоких вен проявилось в увлечении идеей формирования искусственных клапанов. Искусственный клапан предлагали создавать из алло- и гетерогенных материалов (твердой мозговой оболочки, аллогенных створок пульмональных и трикуспидальных клапанов, титановых и платиновых колец).
B. Eiseman и W. Malette (1953), Э.И. Сепп (1974), А.А. Алексеенко и В.М. Лещенко (1974), Р.П. Зеленин (1976) предлагали создавать клапан инвагинацией нижележащего сегмента в вышележащий. Г.Г. Караванов (1973), В.Б. Гервазиев (1978) инвагинировали в просвет магистральной вены культю её крупного притока. В 1964-65 гг. N.D. Psathakis предложил весьма оригинальный метод создания экстравазального механизма, устраняющего рефлюкс по бедренно-подколенному сегменту.
Основу методики составляет перемещение сухожилия нежной мышцы между подколенной артерией и веной с подшиванием его к двуглавой мышце, в расчете на предупреждение рефлюкса крови по подколенной вене за счет её сдавления мышцей при ходьбе. В последующем методика была усовершенствована и отличалась тем, что вместо сухожилия использовалась силиконовая полоска, индифферентная к тканям.
Почти одновременно последовали различные попытки восстановления клапанной функции реканализованных глубоких вен за счет создания интравенозного клапана. Были разработаны П-образные швы, конусовидно суживающие просвет вены, прошивание атравматичной нитью и перевязка половины просвета бедренной вены в двух местах на расстоянии, равном ширине просвета, прошивание вены танталовыми скрепками по дуге (П. Бранзеу, Ж. Руссо, 1960, Р.П. Зеленин, 1967). Основными недостатками данных методик явились сужение просвета вены и тугоподвижность созданных створок клапанов.
Одним из серьёзных достижений в реконструктивной хирургии вен является разработка оперативных вмешательств, восстанавливающих клапанную функцию реканализованных глубоких вен путем переориентирования оттока крови в магистральные поверхностные и глубокие вены, сохранившие полноценные клапаны.
В современной литературе подобного рода вмешательства обычно называются «valvular transposition» – перемещение клапанов (А.Н. Веденский, 1975, R.L. Kistner, 1979). Одним из наиболее распространенных методов является создание анастомоза между проксимальным отделом большой подкожной вены и бедренной вены после её резекции вблизи слияния с глубокой веной бедра. Полноценные клапаны БПВ при этом препятствуют ретроградному кровотоку в дистальном направлении.
При невозможности выполнения реконструктивной операции посредством транспозиции клапанов, наиболее рационально – восстановление их функции путем свободной пересадки. Воплощенная в экспериментальных работах 60-х годов (G. Wadell, 1964, A. McLachlin, 1965) идея восстановления клапанной функции магистральных вен посредством аутотрансплантации клапанов, нашла клиническое применение в 80-е годы.
 Показанием к операции является выраженный патологический рефлюкс крови по глубоким венам нижних конечностей с декомпенсированной ХВН, устойчивой к традиционным консервативным и хирургически методам лечения. Чаще всего в таких случаях для нивелирования венозной гипертензии областью пересадки клапана избирается бедренная вена, вблизи устья глубокой вены бедра.
Показанием к операции является выраженный патологический рефлюкс крови по глубоким венам нижних конечностей с декомпенсированной ХВН, устойчивой к традиционным консервативным и хирургически методам лечения. Чаще всего в таких случаях для нивелирования венозной гипертензии областью пересадки клапана избирается бедренная вена, вблизи устья глубокой вены бедра.
Специалисты, обладающие большим опытом применения данных операций, считают, что более рационально – вос-
становление клапанной функции подколенной вены (S.Raju, P.Labas, В.В.Сабельников). Все авторы единодушны в том, что свободная пересадка клапанов может быть успешной и должна сопровождаться существенным улучшением венозного оттока. Основным фактором, ограничивающим применение данного метода, является несовпадение диаметров аутотрансплантата и замещаемого сегмента, что создает предпосылки к тромбообразованию.
С целью восстановления функции, относительно недостаточных клапанов при варикозной и посттромботической болезнях, предложены методики как их интравазальной, так и экстравазальной коррекции (R.L.Kistner,1988, А.Н.Веденский,1976).
Основоположником прямых вмешательств на створках клапанов – вальвулопластики – по праву является R.L. Kistner (1968). В настоящее время эти работы не утратили своих перспектив и продолжаются, в том числе и в России. Внедряются новые способы вальвулопластики, разработаны специальные приспособления, облегчающие вальвулопластику (И.М.Игнатьев, Р.А. Бредихин, Р.В. Ахметзянов, 2010).
Дальнейшее развитие флебологии неотделимо от метода ультразвуковой диагностики заболеваний вен. Практическое применение метода связано с приоритетной и общепризнанной разработкой нашего соотечественника С.Я. Соколова в ультразвуковой промышленной дефектоскопии (1929, 1935).
Первые сообщения об ультразвуковом исследовании венозной системы появились в 70-х годах ХХ столетия (F.E. Barber et al., 1974). Однако настоящая революция произошла после технического осуществления идеи оценки кровотока, основанной на эффекте Допплера. С появлением ультразвукового ангиосканирования с цветовым картированием потоков крови и допплерографией стало возможным изучение анатомии венозной системы каждого конкретного больного, отношения вен к другим анатомическим структурам, определение времени и протяженности рефлюкса крови по ходу ствола БПВ, а также изучение функционального состояния перфорантных вен. Ультразвуковое дуплексное (триплексное) ангиосканирование очень быстро превратилось в “золотой стандарт” исследования венозной сети. Это первый метод, позволяющий неинвазивно осуществить функциональное и анатомическое исследование одномоментно. Многие авторы утверждают, что информативность УЗАС превосходит флебографию и сравнима с тщательным исследованием во время операции.
Высоко значение этого метода в исследовании рецидивного варикозного расширения вен.
Этот метод позволяет выявить источник возможного рецидива и принять необходимые меры ещё до развития клинической картины рецидива.
Однако, несмотря на все преимущества, практическая ультразвуковая диагностика сегодня всё ещё страдает рядом недостатков. Не касаясь технических аспектов применяемой аппаратуры и компьютерного обеспечения, хочется выделить два из них. Это, прежде всего, субъективизм исследования и неоднозначность трактовки той или иной клинической картины разными специалистами. Вторым, на наш взгляд, недостатком, является частая интерпретация полученных ультрасонографических данных в отрыве от клинической картины. При этом, «вера» результатам инструментального исследования зачастую необоснованно превышает доверие к клиническим данным, что в конечном итоге может вести к ошибкам в тактике лечения больного.
Поиск возможностей минимизировать операционную травму, а то и вовсе обойтись без операции, привел к идее внутрисосудистого воздействия. Ретроспективно рассматривая различные способы воздействия на вену изнутри, можно выделить несколько ключевых этапов.
В начале 19 века лечение варикозного расширения вен по способу Fricke заключалось в проведение иглой в вену нитки и оставление её внутри сосуда для дальнейшего развития флебита и закрытия просвета вены.
Склеротерапия, как метод воздействия на интиму вены химических веществ, появилась после изобретения шприца в 1851 году Charl Gabriel Pravatz. Pravatz, для получения асептического флебита, вводил полуторохлористое железо, другие врачи – хлорал-гидрат, карболовую кислоту, йодтанниновый раствор, растворы соды.
Современный этап развития склеротерапии начинает отсчёт с появления в 1946 г. натрия тетрадецилсульфата – первого реально безопасного препарата, лишенного многих побочных действий. Становление компрессионной склеротерапии во многом обязано работам известного флеболога профессора W.G.Fegan, определившего в шестидесятых годах ХХ века основные принципы этого метода. Но настоящий прорыв в использовании склеротерапии произошёл после изобретения итальянским профессором L.Tessari способа получения микропенной формы препарата. Микропена, распространяясь по сосуду, вытесняет кровь и «обволакивает» изнутри интиму, обеспечивая тем самым тесный и длительный контакт с ней. Кроме этого, микропена прекрасно визуализируется при ультразвуковом сканировании, что позволяет контролировать её распространение. Практически сразу, микропена по методу L.Tessari стала использоваться для склерооблитерации стволов БПВ и МПВ, заменив, в некоторых случаях, кроссэктомию и стриппинг. К сожалению, в этом варианте склеротерапия не оправдала многих надежд и не стала стандартом лечения ВРВНК. Число реканализаций, после проведенной склеротерапии, практически обрекает пациента на обязательные повторные склеротерапии тех же венозных сегментов с интервалами от нескольких месяцев до нескольких лет.
Рефлюкс по магистральным подкожным венам, без их удаления, пытались устранять и с помощью физических факторов. В 1950-х годах K.Firt, L.Heigal, D.Jrivora был предложен метод электрокоагуляции, основанный на коагулирующем действии токов высокой частоты. Электрокоагуляция варикозно-трасформированных вен достигалась при помощи моноактивных и биактивных электродов, подключенных к аппарату диатермии. Вызванный электродами ожог венозной стенки через процесс асептического воспаления завершался фиброзом и рубцеванием. В последующем метод был усовершенствован различными исследователями (С.Р. Лампер 1964—1969, В.Г. Ершов 1968, 1971 и др.). В настоящее время метод электрокоагуляции применяется редко, в связи с частыми осложнениями и рецидивами.
Применение внутренней подсветки – диафаноскопии, трансиллюминации с целью визуализации расположения и хода в подкожной клетчатке вен, способствовало созданию новой техники удаления варикозных вен – трансиллюминационной флебэктомии (ТИФЭ). Технология, разработанная в 1998 году американским флебологом G.Spitz совместно с компанией “Smith & Nephew”, интересна не только возможностью трансиллюминационной визуализацией вариксов, но и такими техническими особенностями, как система гидропрепаровки тканей и орошения, наличие мощного резектора на шейвере. Все эти технические новшества объединены в аппарате TriVex, а полный перевод методики на разные языки обязательно вкючает в себя такие понятия, как «усиленная» (powered – англ., kraftangetriebenen – нем.), «механическая, автоматическая» (motorizada – исп.), «электрическая» (elektrique – франц.). Трансиллюминационный визуальный контроль расположения вены во время операции, контроль самого процесса ее фрагментарного удаления позволяет достичь минимизации количества и длины проколов кожи и значительной экономии времени операции. Отрицательной стороной метода является его относительно высокая травматичность: часто наблюдается повреждение ветвей кожных нервов, лимфатических сосудов и образование обширных гематом.
Консервативная терапия, на протяжении длительного времени, рассматривалась как элемент предоперационной подготовки, либо как часть послеоперационной реабилитационной программы у пациентов с ХЗВНК. Однако в последнее десятилетие произошел, в буквальном смысле слова, переворот в отношении использования фармакотерапии у такой категории больных. Внедрение в клиническую практику нового поколения флеботропных препаратов поливалентного механизма действия (Антистакс, Детралекс, Флебодиа, Вазокет и др.) позволило устранить целый ряд патологических проявлений ХЗВНК. При этом следует учитывать, что назначение фармакотерапии должно быть взвешенными, а период её использования четко ограничен реализацией той или иной задачи лечения.
1.1. Развитие метода эндовенозной лазерной облитерации (ЭВЛО) с момента его появления.
Изобретение лазера предсказал ещё Алексей Толстой. До написания им известного романа «Гиперболоид инженера Гарина», в 1916 году, Альберт Энштейн теоретически обосновал возможность индуцирования внешним электромагнитным полем излучения атомов. В 1939-м сотрудник Московского энергетического института Валентин Фабрикант сформулировал принцип усиления электромагнитного излучения. Это был следующий шаг к изобретению лазера. Несмотря на важность сделанных в его работах выводов, они остались практически незамеченными. В 1955 году ученые Николай Басов и Александр Прохоров разработали квантовый генератор – усилитель микроволн с помощью индуцированного излучения, активной средой которого является аммиак. В 1960-м сотрудник фирмы «Хьюз Эйркрафт», американский физик Теодор Мейман, основываясь на работах Н.Басова, А.Прохорова и Ч.Таунса, сконструировал первый лазер на рубине с длиной волны в 0,69 мкм. Тогда же Чарльз Таунс и Артур Шавлов запатентовали изобретение лазера. Слово «ла’зер» (англ. laser, сокр. от Light Amplification by Stimulated Emission of Radiation – усиление света посредством вынужденного излучения) означает устройство, преобразующее энергию (световую, электрическую, тепловую, химическую и др.) в энергию узконаправленного потока излучения.

Чарльз Хард Николай Геннадевич Александр Михайлович
Таунс Басов Прохоров
В 1964-м изобретателям лазера была присуждена Нобелевская премия. Лауреатами стали американец Чарльз Таунс и два российских физика – Николай Басов и Александр Прохоров.
Медицинская техника, создаваемая на основе первых лазеров, отличалась сложностью в эксплуатации, необходимостью присутствия в операционной квалифицированного технического персонала. Лазерные установки требовали выделения отдельной операционной, в силу громоздкости оборудования и необходимости наличия мощных источников питания. Также они требовали наличия в штате инженеров для обслуживания и юстировки оборудования. Однако лазеры, несмотря на трудности, совершенствовались, и находились новые области их применения.
Сообщения о первых применениях лазеров во флебологии относятся к 1981 г. R.R. Anderson, J.A. Parrish, используя лазер на красителях с длиной волны 577 нм, вызывали повреждение микрососудов кожи. В основе технологии лежал эффект избирательного поглощения различными компонентами тканей лазерной энергии определенной длины волны, что приводило к их избирательному разрушению. В 1983 году в опытах in vivo было показано селективное повреждение окрашенных структур, клеток и их органелл. Точного «наведения» на объект воздействия также не требовалось, так как длина волны лазера и обеспечивала селективность повреждения (R.R. Anderson, J.AParrish). В том же 1983 году в опытах на животных была показана возможность селективной коагуляции и микрососудистого гемостаза при внутрисосудистом воздействии лазерного излучения (R.R. Anderson, J.AParrish).
В 90-х гг. XX века, с появлением новых полупроводниковых структур, стало возможным производить компактные лазеры, с большим ресурсом работы при низкой себестоимости. Лазерные аппараты позволяли генерировать излучение в десятки, а затем и в сотни ватт. Постепенное развитие средств доставки лазерного излучения привело к появлению оптических волокон из кварца с минимальным поглощением световой энергии. Таким образом, к концу 90-х годов создались технические предпосылки для возникновения и развития ЭВЛО в лечении хронических заболеваний вен нижних конечностей.
Опубликованы результаты исследований, посвященных изучению оптических свойств крови (конференция Laser-Tissue Interaction, Tissue Optics, and Laser Welding III, Сан-Ремо, Италия, 1997 г.). André Roggan с соавт. (1999) провели работу по изучению оптических свойств крови при использовании лазерного излучения с длинами волн от 400 до 2500 нм. Результатом стали данные о поглощении энергии кровью и её оптическими составляющими (гемоглобином и водой). Были определены оптимальные длины волн лазерного излучения, максимально поглощающиеся разными веществами крови. Полученный ими график по сегодняшний день используется во всех работах по ЭВЛО.
В 1998—1999 г. появились первые сообщения C. Boné о клиническом внутрисосудистом применении диодного лазера (810 нм) для ЭВЛО при ВРВНК. Метод получил название EVLT (endovenous laser treatment).
В 2001 г . L. Navarro, R.J. Min, C. Boné обобщили и опубликовали свои данные о внутрисосудистом введении лазерного световода для доставки энергии лазерного излучения в БПВ. Авторами был использован диодный лазер с длиной волны 810 нм. После одного года наблюдений облитерация вен регистрировалась у 100 % пациентов.
Процесс тромботической окклюзии после термического воздействия лазерного излучения всесторонне изучен и детально описан в 2002 г. T.M. Proebstle с соавт. По мнению авторов, механизм ЭВЛО основан на поглощении световой энергии гемоглобином и непрямом действии тепловой энергии на стенку сосуда. В результате термического воздействия на кровь образуются пузырьки пара, которые и обладают повреждающим действием на эндотелий венозной стенки. Объем образующихся пузырьков пара коррелирует с мощностью энергии лазерного луча. При этом максимальная глубина проникновения собственно лазерного луча сквозь цельную кровь составляет 0,3 мм (при длине волны 940 нм). С момента публикации результатов этого исследования прочно укрепилось мнение о том, что само лазерное излучение не вызывает повреждение эндотелия, так как полностью поглощается гемоглобином.
В России впервые результаты использования высокоэнергетического лазера были опубликованы в 2001 году сотрудниками Медицинского центра ЦБ РФ Назаренко Г.И. и соавт. Применив новую методику у 75 пациентов, дополнив ЭВЛК кроссэктомией, авторами была получена облитерация БПВ в 92% случаев (8% реканализаций в первую неделю).
На прошедшем в июне 2007 г. в г. Киото (Япония) азиатском конгрессе Международного союза флебологов были доложены результаты первых рандомизированных мультицентровых исследований. Японские хирурги T.Ogawa, S. Hoshino, S.Makimura и соавт., проводили сравнения инвагинационного стриппинга и эндовенозной лазерной облитерации. Сравнивались данные УЗАС, результаты воздушной плетизмографии и показатели качества жизни по вопросникам CIVIQ2. Принципиальных отличий по перечисленным параметрам выявлено не было, однако длительность госпитализации была значимо ниже после ЭВЛО. Датские исследователи L.H.Rasmussen, L.B.Rasmussen, M.Lawaetz и др., также сравнивали результаты ЭВЛО и PIN-стриппинга по Oesh. При отсутствии принципиальных отличий между этими двумя методами, авторы указывают на более высокую стоимость ЭВЛО. Немецкий флеболог O.Gockeritz высказал мысль о необходимости создания устройства, позволяющегося автоматически изменять энергетические параметры лазерного излучения в процессе выполнения ЭВЛО, в зависимости от свойств вены. J.Kingsley (США) один из первых доложил об эффективности 1320 нм лазера, который при мощности в 6 Вт позволяет добиться стойкой облитерации БПВ в 98% случаев.
В 2008 году в Афинах (Греция) состоялся XXIII всемирный конгресс Международного общества ангиологов. Были доложены результаты ликвидации перфорантного сброса при помощи ЭВЛО. T.Proebstle (Германия) сообщил о 100% облитерации 67 перфорантных вен при потоке энергии в 50Дж. J.Elias (США) добился облитерации в 90% случаев при энергетических параметрах в 180 Дж.
В июне 2008, в г. Барселоне, на IX конференцию Европейского венозного форума собрались около 250 специалистов со всей Европы. В своём выступлении итальянский флеболог A.Cavezzi поделился своим опытом ЭВЛО. Критерием отбора пациентов служил диаметр БПВ (МПВ) не менее 5 мм и не более 10-12 мм. Автор использовал плотность потока энергии 60-80 Дж/см. В выводах доктор A.Cavezzi высказал мнение, что метод ЭВЛО имеет большое будущее, а в настоящее время нуждается в совершенствовании и стандартизации.
XV конгресс Международного союза флебологов, проходивший в 2009 г. в Монако, собрал более 1500 специалистов со всего мира. На конгрессе было доложено об испытании нового типа световодов, получивших название JACKET. От обычных их отличает сферический рабочий конец, который позволяет создать равномерное распределение лазерной энергии по периметру сосуда. Кроме того, этот тип световодов не требует использования проводников и катетеров для заведения в сосуд. L.Kabnick (США) представил результаты рандомизированного клинического исследования, в котором сравнивалась эффективность радиочастотной облитерации и ЭВЛО с катетером «JACKET». Автор не выявил принципиальных различий по продолжительности процедуры, скорости послеоперационной реабилитации, эффективности облитерации и частоте осложнений. При этом стоимость расходных материалов для ЭВЛО оказалась значительно ниже.
Технология ЭВЛО продолжает пользоваться нарастающим интересом, как у хирургов, так и у их пациентов. Растёт количество публикаций по данной тематике. Вышли в свет первые монографии и методические пособия (Соколов А.Л., Лядов К.В., Стойко Ю.М., 2007; Шевченко Ю.Л., Батрашов В.А, Мазайшвили К.В.и соавт., 2010).
В мае 2010 года в г. Москве состоялась VIII научно-практическая конференция Ассоциации флебологов России с международным участием. Президентом Ассоциации флебологов России академиком РАМН и РАН В.С.Савельевым были определены научные и практические направления развития современной флебологии. Эндовенозной лазерной облитерации было посвящено рекордное число сообщений, причём впервые звучали доклады, посвященные ошибкам, опасностям и осложнениям ЭВЛО. Факт появления выступлений такой тематики говорит о постепенной смене увлечённости этим методом на переосмысленный и осторожный подход за счёт накопленного опыта.
В НМХЦ им. Н.И.Пирогова ЭВЛО проводится с 2002 года. Эта технология активно применяется как в стационаре, так и в амбулаторных условиях на базе поликлиник Центра. Опыт лечения с применением ЭВЛО составляет более 3000 пациентов. Активно проводится обучение специалистов. В институте усовершенствования врачей НМХЦ им. Н.И.Пирогова создан отдельный цикл, посвященный эндовенозной лазерной облитерации в лечении патологии вен нижних конечностей.
Следует отметить, что окончательный ответ на вопрос об эффективности метода могут дать только результаты отдалённых наблюдений. По нашим данным, полная окклюзия БПВ (МПВ) в отдаленном периоде достигается у 94,5% оперированных больных.
В настоящее время появляются новые технические устройства для выполнения ЭВЛО. Сотрудниками НМХЦ им. Н.И.Пирогова совместно с производителями лазерных аппаратов «ЛАМИ» разработано специальное устройство, позволяющее проводить тракцию световода при ЭВЛО в автоматическом режиме. Данное устройство может работать в режиме обратной связи, т.е. позволяет автоматически регулировать длительность лазерного воздействия в зависимости от калибра вены и степени её коагуляции. Создание такого устройства позволило вплотную подойти к стопроцентной воспроизводимости метода. Именно низкая воспроизводимость ЭВЛО является основным препятствием на пути его широкого внедрения. Такое устройство может стать технической основой в создании стандартов ЭВЛО.
До сих пор нет единого мнения о плотности потока энергии лазерного излучения, достаточной для надёжной облитерации вены. Практически ни у кого уже нет сомнений, что эти значения должны быть не менее 60-70 Дж/см (N.S. Theivacumar. et al., 2009). Тем не менее, выше этих цифр значения плотности потока энергии, применяемые разными авторами, отличаются в разы.
Отсутствие единых стандартов ЭВЛО является основным недостатком методики как в России, так и за рубежом, что делает метод сильно зависимым от опыта хирурга. Стандарт технологии ЭВЛО должен включать в себя три основные части:
Четкое определение показаний и противопоказаний к ЭВЛО.
Пошаговый протокол ЭВЛО, включающий расчёт энергии, подаваемой в сосуд.
Послеоперационный контроль.
Априорно частота рецидивов после ЭВЛО должна быть выше, чем после традиционной флебэктомии. Увеличение частоты рецидивов должно происходить за счет двух основных факторов: реканализации и «длинной» культи магистральной подкожной вены. Несмотря на это, технология ЭВЛО имеет большие перспективы, прежде всего за счет её миниинвазивности и амбулаторности. Стандартизация технологии ЭВЛО и выбор оптимальной длины волны уменьшит количество послеоперационных рецидивов и окончательно определит судьбу метода в лечении ХЗВНК.
Глава 2. Эмбриогенез и анатомо-физиологические данные венозной системы нижних конечностей. (Совместно с Т.В.Хлевтовой).
2.1. Эмбриогенез вен нижних конечностей
Распространенность патологии вен нижних конечностей, в частности, варикозной болезни (ВБ), у человека необычайно высока. Большую роль в её возникновении и развитии играет врожденная предрасположенность, которая реализуется, в том числе, через закладку венозной системы в эмбриональном периоде.
В процессе эволюции, при переходе предка человека к прямохождению, должны были сформироваться особенности строения венозной системы нижних конечностей, направленные на компенсацию возросшего гидростатического давления. С позиции эволюционизма, очевидно, что закладка венозной системы в эмбриогенезе может происходить в трех вариантах:
атавистическом, при котором закладывается анатомический вари-ант строения, более характерный для ранних этапов эволюции человека, и, соответственно, менее приспособленный для прямохождения;
аккомодантном (от лат. аccomodatio – приспособление), который в эволюционном отношении является наиболее оптимальным вариантом венозной системы, и предполагает низкую вероятность развития хронической венозной недостаточности (ХВН).
футуристическом, при котором закладывается вариант строения венозной системы, до этого никогда ранее не существовавший у Homo sapiens. Этот вариант развития имеет поисковый характер и может быть как полезным, так и вредным, а также индифферентным.
Так как варикозная болезнь возникает в филогенезе человека одновременно с прямохождением, есть основания полагать, что атавистический вариант закладки является фундаментом для возникновения и развития варикозного расширения вен. При таком взгляде на проблему открываются новые подходы к оценке риска возникновения и развития ХВН. Зная соответствие варианта закладки венозной системы определенному анатомическому типу строения, можно, с большой долей вероятности, ещё в раннем возрасте определить группу лиц с высоким риском возникновения ВБ. Таким образом, мы можем близко подойти к реализации неосуществленной до сих пор идеи целенаправленной профилактики развития ВБ и ХВН у людей с высоким риском ещё на доклинической стадии.
Установить анатомические критерии для каждого из вариантов закладки венозной системы можно только на основании данных о строении венозной системы на различных стадиях онто- и филогенеза. Работ, посвященных эмбриогенезу венозной системы нижних конечностей, крайне недостаточно. Публикации, которые освещают те или иные вопросы этой тематики, зачастую имеют противоречия в двух принципиальных вопросах: сроках формирования того или иного венозного отдела и источниках образования этих отделов.
Онтогенез нижних конечностей человека сложен и включает в себя ряд последовательных этапов. Зачатки нижних конечностей возникают у эмбриона уже на 27–28 сутки внутриутробного развития. Вначале они представляют собой выпячивания, состоящие из мезенхимальных клеток. Покрывает будущую конечность тонкий слой клеток эктодермы. На верхушке каждого зачатка слой эктодермы утолщается, образуя многослойный гребень, лишенный сосудов и называемый апикальным. Этот гребень оказывает особое влияние на нижележащую массу мезенхимы, инициируя рост конечности. Мезенхима содержит массу быстроделящихся клеток, за счет которых происходит дальнейший рост зачатка конечности. Мезенхимальные клетки, находящиеся в проксимальной части, постепенно дифференцируются, образуя сосуды и мезенхимальную (до 6 недели), а затем хрящевую модель скелета. Центры оссификации появляются в хрящевых моделях длинных трубчатых костей к 12 неделе внутриутробного развития. Миобласты, предшественники мышечных клеток, мигрируют в почки конечностей из дерматомиотомных участков сомитов (сомиты – симметричные парные бугорки, лежащие по обе стороны от хорды). По мере формирования костей, миобласты скапливаются вокруг них и образуют пласты мышечной ткани, постепенно дифференцирующиеся в дорсальный (разгибательный) и вентральный (сгибательный) компоненты (Милованов А.П., 2006). В течение 5-й недели нервные стволы из люмбосакральных сплетений врастают в массу мезенхимальной ткани зачатка конечности (Buckingham M., 2003).
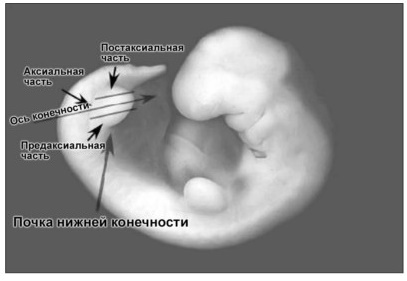
Рис 1. Эмбрион человека на 31-е сутки после оплодотворения. Четко визуализируются зачатки нижних конечностей. Осевая линия делит почку на преаксиальную (краниальную), аксиальную (осевую) и постаксиальную (каудальную) части.
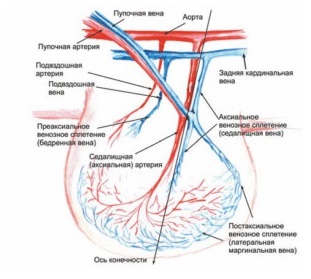
Рис 2. Схема кровоснабжения зачатка нижней конечности эмбриона человека на 38–39-е сутки внутриутробного развития. Определяются 3 главные оси венозного оттока. Основной дренаж крови осуществляется через постаксиальное венозное сплетение.
Вначале появляются аксоны двигательных нейронов, врастающие в образующуюся мышечную ткань вентральной и дорсальной областей. Чувствительные ветви появляются вслед за двигательными, используя последние в качестве направляющих для своего роста. Ветви нервов разделяют будущую конечность на дерматомы, которые сохраняются и во взрослом состоянии. Осевая линия, условно проведенная вдоль седалищного (аксиального) нерва, делит конечность на три части: преаксиальную (краниальную), аксиальную (осевую) и постаксиальную (каудальную) (рис. 1).
В начале 7-й недели конечность вытягивается. Окончательно дифференцируются ее дорсальная (разгибательная) и вентральная (сгибательная) части, а также отделы, лежащие на границе между ними: преаксиальный (краниальный) и постаксиальный (каудальный). В это время происходит медиальный разворот конечности на 90 градусов, так что разгибательная группа мышц становится лежащей по передней поверхности конечности. Примерно на 49-е сутки после оплодотворения можно определить лучи будущих пальцев в дистальной части конечности, в зоне формирующейся стопы.

Рис.3 Схема оттока крови на 50-е сутки внутриутробного развития. Появление «взрослых» глубоких сосудов и образование межвенозных анастомозов. Основным венозным коллектором становится преаксиальное сплетение.
Самая первая артериальная система зачатка нижней конечности состоит из первичной аксиальной артерии и её ветвей (рис.2). Постепенно первичная аксиальная артерия, пройдя ряд последовательных стадий, трансформируется в глубокую бедренную артерию на бедре, заднюю большеберцовую артерию и переднюю большеберцовую артерию — на голени.
В эмбриогенезе венозной системы нижних конечностей человека условно можно выделить три ключевые фазы:
— образование первичной венозной сети, предшественника поверх-ностной системы вен.
— формирование глубокой системы вен
— создание многочисленных анастомозов, ведущих к формированию окончательно оформленных путей венозного оттока.
Первичная венозная сеть расположена поверхностно и развивается вдоль индуцирующих ее рост нервов. Только затем образуется глубокая система, которая вначале имеет вид лакун, идущих вдоль одноименных артерий, и в дальнейшем ее рост и развитие происходят параллельно с этими артериями. В этом заключается различие между поверхностной и глубокой венозной системами. Кроме этого, не только в онто- но и в филогенезе поверхностная венозная сеть появляется гораздо раньше глубокой (Cameron J., 1982).
Применительно к возникновению и развитию путей оттока венозной крови от нижних конечностей, на сегодняшний день наиболее признанной считается теория трех направляющих нервных осей (Gillot C.,1998; Uhl J.-F., 2007). Поверхностная венозная система появляется в зачатке конечности уже у 6-недельного эмбриона. Она представлена тремя коллекторами, отводящими кровь в задние кардинальные вены. Последние представляют собой магистральные венозные сосуды, расположенные по бокам от хорды и дренирующие заднюю часть эмбриона (нижней полой вены на этой стадии еще не существует). Эти три коллектора идут вдоль направляющих их рост нервов:
Вентрально расположен преаксиальный или бедренный нерв. Он отдает чувствительную ветвь, называемую nervus saphenus. Венозное сплетение, образующееся вокруг этого нерва, называется преаксиальным. В последующем оно разделяется на большую подкожную вену (БПВ) и бедренную вену (БВ).
Вдоль оси конечности идет седалищный или аксиальный нерв. Венозное сплетение, идущее вдоль этого нерва, называется осевым (аксиальным) или седалищным.
Постаксиальное венозное сплетение следует дорсально вдоль малого седалищного нерва, который у взрослого человека представлен задним кожным нервом бедра. Он идет вниз, вдоль задней оси нижней конечности.
Образование первичной венозной сети. Доподлинно известно, что вначале образуется так называемое первичное капиллярное сплетение. Предшественники эндотелиальных клеток, рассеянные по мезенхиме, образуют агрегаты, которые затем принимают вид примитивных трубок, состоящих из одного слоя эндотелиальных клеток (Creton D., 2005). Эта примитивная капиллярная сеть позволяет протекать по ней крови, но постепенно становится функционально недостаточной, что заставляет капилляры конденсироваться. Под воздействием факторов роста к этим капиллярам мигрируют гладкомышечные клетки (Haigh J.J., 2000; Vargesson N., 2003). Так образуется первый кровеносный сосуд зачатка конечности – осевая или аксиальная артерия. Наиболее дистально расположенные венозные капилляры также сливаются и образуют так называемый маргинальный синус (Ambler C.A., 2001). Существующие в первичной капиллярной сети многочисленные анастомозы, по мнению некоторых авторов (Brand-Saberi B., 1995), под воздействием тератогенных факторов могут сохраниться, приводя в дальнейшем к возникновению ангиодисплазий в виде артерио-венозных фистул.
С образованием кровеносных сосудов первичный дренаж крови осуществляется от зачатка нижней конечности через постаксиальное венозное сплетение. Это происходит примерно на 38–39-е сутки после оплодотворения, когда длина эмбриона составляет всего около 8–9 мм. У основания зачатка конечности постаксиальная вена дренируется в седалищную и далее – в таз. Там первое время кровь попадает в пупочную и частично в заднюю кардинальную вену. Затем кровоток полностью перенаправляется в последний сосуд. Постаксиальное венозное сплетение, называемое иначе эмбриональная латеральная маргинальная вена, является прообразом малой подкожной вены. На данной стадии именно она становится главным магистральным венозным коллектором формируемой нижней конечности (рис. 2). Артериальный приток в это время осуществляется аксиальной артериальной системой – седалищная артерия отходит прямо от пупочной артерии и спускается в развивающийся зачаток нижней конечности (Дан В.Н., 2008). Таким образом, на этой стадии, продолжающейся примерно от 37 до 50 суток после оплодотворения, как приток, так и основной отток крови от нижней конечности осуществляется системой пупочных сосудов.
Следующая по срокам развития – большая подкожная вена, которая возникает примерно на 44–45-е сутки напрямую из задней кардинальной вены. Одновременно из нее же развивается еще один дренирующий сосуд – прообраз БВ (Smith D.E., 1997). Это связано с дальнейшим удлинением конечности, прежде всего с ростом бедра. Возникновение БПВ и БВ является началом перестройки системы венозного оттока от постаксиальной системы, дренирующей кровь через седалищную вену, к преаксиальной системе БПВ и бедренных сосудов. На 50-е сутки нижняя конечность напоминает ласту за счет лучей образующихся пальцев. Происходит тазовая ротация (на 90°) и значительное удлинение конечности, дренирующая система окончательно передвигается вперёд от постаксиальной системы к преаксиальной системе подвздошных вен (Cameron J.,1982). Начинают появляться «взрослые» глубокие вены (Smith D.E., 1997). В этот момент основной отток крови осуществляется через БПВ.
Артериальный приток претерпевает похожие изменения. Бедренная артерия, ветвь наружной подвздошной артерии, входит в конечность и в canalis adductorius анастомозирует с седалищной артерией. Седалищная артерия попадает на переднюю поверхность через ramus perforans cruris, которая пенетрирует проксимальную часть пространства между образующимися берцовыми костями (Дан В.Н., 2008). Из ramus perforans cruris «вырастает» передняя большеберцовая артерия.
Если на описанной стадии редукция эмбриональных седалищных сосудов задерживается, то могут развиться такие виды ангиодисплазий, как синдром Клиппель-Тренноне; персистирующие седалищная и латеральная маргинальная вены; персистирующая седалищная артерия (Baskerville P.A., 1985; Brand-Saberi B., 1995; Paraskevas G., 2004; Дан В.Н., 2008).
Формирование глубокой системы вен и межсистемных венозных анастомозов. Именно удлинение конечности с тазовой ротацией, происходящие примерно на 50-е сутки после оплодотворения, можно считать рубежом, на котором заканчивается основная роль первичной поверхностной сети (системы эмбриональной латеральной маргинальной вены, прообраза малой подкожной вены (МПВ)) в оттоке венозной крови. В результате происходящей ротации (окончательно она заканчивается только после рождения), дорсальная поверхность конечности превращается в переднюю, а вентральная – в заднюю. Соответственно, расположенная ранее впереди, преаксиальная система венозных коллекторов становится медиальной, а располагавшаяся каудально постаксиальная система МПВ смещается на заднюю поверхность конечности. Для перенаправления кровотока из системы седалищной (аксиальной) в систему бедренных (преаксиальных) сосудов начинаются образовываться межсистемные венозные анастомозы. Поскольку основной дренаж крови смещается в БПВ, возникающие анастомозы идут от постаксиального (МПВ) в преаксиальное сплетение. По ним почти вся кровь от голени уходит в БПВ. Этот анастомоз сохраняется и во взрослом состоянии в виде краниального продолжения МПВ (бедренно-подколенного тракта, вены Джиакомини) (Martinez R., 2001).
Постепенно, с дальнейшим ростом конечности, основной отток крови начинает смещаться в глубину, от БПВ в БВ. Это связано с тем, что глубокая венозная ось конечности становится функционально самым коротким путем к венозному коллектору основания растущей конечности. Образуется аксиально-преаксиальный анастомоз между седалищной и бедренной венами. БВ окончательно становится основным дренирующим сосудом нижней конечности (рис.3). С этого момента седалищная вена окончательно утрачивает свое значение и постепенно атрофируется (во взрослом состоянии она сохраняется лишь в виде небольших аркад вдоль седалищного нерва и нижней ягодичной вены). Аксиальнопреаксиальный анастомоз, расположенный вентрально по отношению к оси конечности, со временем превращается в глубокую вену бедра.
Наступает момент образования многочисленных анастомозов и формирования окончательного вида венозной системы. Уровень подколенной вены становится в этот период перекрестьем трех основных венозных осей. Седалищная вена анастомозирует с растущей вниз бедренной веной, образуя подколенную вену. Последняя , в конечном итоге, «захватывает» венозный дренаж из МПВ. Происходит формирование вначале подколенной вены, а затем сафено-поплитеального соустья (СПС). После того, как бедро вытягивается из туловища, МПВ обособляется и теряет связь с седалищной системой. Поскольку это происходит достаточно поздно как в онто- , так и в филогенезе, мы можем наблюдать значительную вариабельность в расположении СПС (Cameron J., 1982; Gillot C., 1998; Barberini F., 2006). Кроме собственно СПС, во взрослом состоянии могут сохраняться и другие анастомозы МПВ с глубокими венами. Они, бесспорно, являются пережитками постакисально–аксио–преаксиальных анастомозов, существовавших в период эмбрионального развития. Описаны три таких вены-остатка эмбриональных межвенозных анастомозов (Gillot C., 1998):
Краниальное продолжение малой подкожной вены (задняя подкожная вена, бедренно-подколенный тракт, вена Джиакомини). Продолжается от подкожной части СПС вверх и вдоль заднего кожного нерва бедра, по срединной линии. В верхней части изменяет свой ход медиально и соединяется с БПВ.
Задняя субфасциальная вена – начинается от СПС и идет по задней поверхности бедра субфасциально, затем теряется в массиве задней группы мышц бедра; часто она анастамозирует с глубокой веной бедра или с аркадами вдоль седалищного нерва – остатками седалищной вены.
Задняя вена бедра – отходит от СПС или подколенной вены (ПВ) и лежит вдоль задней поверхности бедренной кости, анастомозируя с глубокой веной бедра или с остатками седалищной вены.
Отдельного внимания заслуживают перфорантные вены. Работ, посвященных их возникновению и развитию в эмбриогенезе, совсем мало. Известно, что они присутствуют уже у шестнадцатинедельного эмбриона (Flisinski P., 2004). Безусловно, их образование также является следствием возникновения анастомозов между венозными стволами в эмбриональный период развития. При всем этом, механизмы их возникновения остаются практически неизученными.
Окончательно венозная система принимает вид, близкий к «взрослому», к 13 неделе внутриутробного развития. В этот же период появляются клапаны в поверхностных и глубоких венах конечностей (CzarniawskaGrzesinska M., 2002, 2003).
Несомненно, описание механизма развития венозной системы неполно. В закладке и формировании венозной системы нижних конечностей остается ещё много белых пятен. Открытым остаётся вопрос об образовании сафено-феморального соустья (СФС), рефлюкс по которому служит краеугольным камнем в развитии варикозной болезни у большинства больных. Неизвестны точные сроки его возникновения. Так как СФС имеет постоянную анатомическую локализацию практически у всех людей, то вероятно его формирование является каким-то важным этапом эмбриогенеза. Вполне возможно, оно служит индуктором для дальнейшего органогенеза вен (а может и не только вен) нижних конечностей. Как уже указывалось, источником образования БПВ и БВ служит преаксиальное венозное сплетение. При этом БПВ возникает сразу отдельным сосудом из задних кардинальных вен и только затем соединяется с БВ (Smith D.E., 1997). Однако неясно, образуются ли сразу два отдельно лежащих сосуда (БПВ и БВ) или существует какой-то сосудпредшественник, который в определенный момент времени разделяется в области будущего СФС. В первом варианте, в какой-то момент времени должен произойти «захват» БПВ бедренной веной. Изучая анатомию этой зоны, мы находим вариабельность количества и места впадения притоков в БПВ, при постоянстве самой зоны соустья БПВ с БВ. На основании этого, более вероятным нам представляется образование двух сосудов (БПВ и БП) в зоне соустья с последующим «захватом» в него притоков БПВ. Сафено-феморальное, как и сафено-поплитеальное соустье, имеет свои особенности строения у разных людей. Является ли тот или иной вариант строения соустья, формируемый при закладке, атавистическим, аккомодантным или футуристическим – покажет дальнейшее изучение развития венозной системы в онто- и филогенезе.
Не до конца раскрыт механизм образования так называемого латерального варикоза. В литературе давно утвердилось мнение, что эта патология имеет своим источником остаток эмбриональной латеральной вены (Mattassi R., 2007). Представление это достаточно аргументировано и основано, большей частью, на схожести проявлений латерального варикоза и клинической картины при синдроме Клиппель-Тренноне (Стойко Ю.М., 2002). Между тем, при изучении эмбриогенеза венозной системы мы не нашли бесспорных указаний на связь эмбриональной латеральной вены (т.е. постаксиального венозного сплетения, прямого предшественника МПВ) и расширенного притока БПВ, который мы наблюдаем при латеральном варикозе.
В филогенезе у тетраподых (т.е. имеющих четыре конечности) животных основным поверхностным венозным коллектором служит МПВ. Даже у наших ближайших родственников – обезьян, основной дренаж крови от поверхностных структур задних конечностей осуществляет МПВ (Dyl Ł., 2007). Смещение основного венозного оттока от МПВ к БПВ произошло, по-видимому, в результате перехода к прямохождению. Это одно из приспособительных изменений, связанное со значительным удлинением конечности и прежде всего – бедра. Нагрузка возросшим объемом крови на удлиненный ствол БПВ, окруженный недостаточно прочным фасциальным футляром, вполне вероятно может приводить к функциональной его неполноценности у определенной части человеческой популяции. При этом следует отметить, что на голени, претерпевшей в процессе эволюции меньшее удлинение, фасциальный футляр БПВ гораздо толще и прочнее, и варикозная трансформация ствола БПВ в нижней и средней трети голени встречается редко.
СПС у тетраподых животных находится достаточно высоко. Существует мнение, что в филогенезе млекопитающих оно смещалось дистальнее, а его расположение в подколенной ямке стало свойственно только человеку. В связи с этим низко расположенное СПС предрасполагает к развитию несостоятельности его клапанного аппарата (Creton D., 2005).
Таким образом, и с позиций эволюционизма гипотеза «врожденного фундамента» для возникновения заболеваний вен нижних конечностей представляется достаточно обоснованной. Эволюция человека, а вместе с ним венозной системы нижних конечностей, продолжается.
Для раскрытия механизмов, которые предшествуют развитию патологии вен нижних конечностей, мы посчитали важным выделить следующие приоритетные направления дальнейших эмбриологических исследований:
Точное определение источника и сроков образования БПВ и БВ.
Определение механизма и сроков формирования СФС.
Определение источника и сроков образования латерального притока БПВ.
Изучение этапов и срока образования фасциальных футляров магистральных вен.
К настоящему моменту в эмбриологии венозной системы нижних конечностей имеется больше вопросов, чем ответов на них. Изучение фундаментальных механизмов развития человека и ответы на эти вопросы могут не только открыть новые теоретические горизонты, но и иметь прикладное значение в клинической практике.
2.2. Анатомия венозной системы нижних конечностей.
Первая попытка создать классификацию поверхностной венозной сети нижних конечностей в нашей стране принадлежит известному отечественному анатому В.Н.Шевкуненко (1949). Он считал, что происходящая в эмбриогенезе редукция первичной венозной сети приводит к возникновению магистральных подкожных стволов. В соответствии с этим, все возможные варианты строения он разделил на три типа: а) тип неполной редукции; б) тип крайней степени редукции и в) промежуточный тип (Рис. 4).
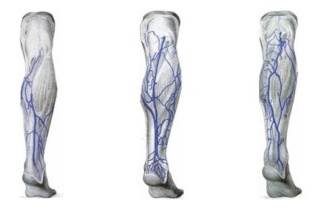
Рис. 4. Типы изменчивости поверхностных вен нижних конечностей (Шевкуненко В.Н., 1949)
а – магистральный тип б – промежуточный тип в – рассыпной тип
Если в поверхностной венозной системе, преимущественно на голени, доминирует промежуточный тип строения вен, то для глубоких вен наиболее распространена магистральная форма, являющаяся результатом крайней степени редукции первичной венозной сети. При данной форме глубокие вены представлены двумя равноценными стволами, с малым числом анастомозов между ними. При рассыпной форме – вены голени многоствольные, с большим числом анастомозов. Промежуточная форма занимает среднее положение. Все три типа строения поверхностной венозной системы нижних конечностей (магистральный, рассыпной и промежуточный) изучены достаточно подробно и не вызывают существенных споров (рис. 4). Значительно больше разногласий существует в описании особенностей строения глубоких вен на различных уровнях нижней конечности, особенно их взаимосвязи между собой. Истоками нижней полой вены являются вены стопы, где они образуют две сети – кожную венозную подошвенную сеть и кожную венозную сеть тыла стопы. Общие тыльные пальцевые вены, входящие в состав кожной венозной сети тыла стопы, анастомозируя между собой, образуют кожную тыльную венозную дугу стопы. Концы этой дуги продолжаются в проксимальном направлении в виде двух продольных венозных стволов: латеральной краевой вены (v. marginalis lateralis) и медиальной вены (v.marginalis medialis). Продолжением этих вен на голени являются, соответственно, малая и большая подкожные вены.
На подошвенной поверхности стопы выделяют подкожную венозную подошвенную дугу, которая широко анастимозирует с краевыми венами и посылает в каждый межпальцевой промежуток межголовчатые вены, которые анастомозируют с венами, образующующими тыльную дугу. Глубокая венозная система стопы формируется из парных вен-спутниц, сопровождающих артерии. Эти вены образуют две глубокие дуги: тыльную и подошвенную. Поверхностные и глубокие дуги связаны многочисленными анастомозами. Из тыльной глубокой дуги формируются передние большеберцовые вены (vv. tidiales anteriores), из подошвенной (vv. tidiales posteriores) – задние большеберцовые, принимающие малоберцовые (vv. peroneae).
Таким образом, тыльные вены стопы переходят в передние большеберцовые, а подошвенные медиальные и латеральные образуют задние большеберцовые вены.
Венозные клапаны имеются лишь в наиболее крупных венах стопы. Их локализация и количество непостоянны. Поверхностная венозная система стопы связана с глубокой системой сосудами, не имеющими клапанов. Этот факт имеет немаловажное значение в клинической практике, так как введение различных лекарственных и контрастных веществ в поверхностные вены стопы в дистальном направлении обеспечивает беспрепятственное поступление их в глубокую венозную систему нижней конечности. Благодаря этой анатомической особенности, возможно также измерение венозного давления в глубоких венах сегмента стопы, путем пункции поверхностной вены стопы. По данным ряда авторов на уровне стопы находится около 50 таких сосудов, из которых 15 расположены на уровне подошвы.
Венозная система голени представлена тремя основными глубокими коллекторами (передними, задними большеберцовыми и малоберцовыми) и двумя поверхностными — большой и малой подкожными венами. Поскольку основную нагрузку в осуществлении оттока с периферии несут задние большеберцовые вены, в которые дренируются малоберцовые вены, именно характер их поражения определяет выраженность клинических проявлений нарушений венозного оттока из дистальных отделов конечности.
Большая подкожная вена нижней конечности (v. saphena magna), являясь продолжением медиальной краевой вены (v. marginalis medialis), переходит на голень по переднему краю внутренней лодыжки, далее проходит вдоль медиального края большеберцовой кости и, огибая сзади медиальный мыщелок бедренной кости, в области коленного сустава переходит на внутреннюю поверхность бедра.
Малая подкожная вена (v. saphena parva) является продолжением наружной позадилодыжечной краевой вены стопы (v. marginalis lateralis). Проходя позади наружной лодыжки и направляясь кверху, малая подкожная вена сначала располагается по наружному краю ахиллова сухожилия, а затем ложится на его заднюю поверхность, приближаясь к средней линии задней поверхности голени. Обычно, начиная с этой области, вена представлена одним стволом, реже – двумя стволами. На границе средней и верхней трети голени малая подкожная вена проникает в толщу глубокой фасции и располагается между ее листками. Достигнув подколенной ямки, она прободает глубокий листок фасции и впадает в подколенную вену. Реже, малая подкожная вена, проходя выше подколенной ямки, впадает в бедренную вену или притоки глубокой вены бедра, а иногда заканчивается в каком-либо притоке большой подкожной вены. Часто в своем терминальном отделе вена раздваивается и впадает в глубокие или подкожные вены двумя стволами. В верхней трети голени малая подкожная вена образует многочисленные анастомозы с системой большой подкожной вены.
Большая и малая подкожные вены на своем протяжении имеют большое количество глубоких ветвей. Глубокие вены голени в верхней трети ее образуют подколенную вену, истоками которой служат задние и передние большеберцовые вены.
Поверхностные вены сообщаются с глубокими посредством перфорирующих вен или перфорантов (vv. perforantes). Первое описание перфорантных вен принадлежит русскому ученому Ю.Х. Лодеру (1803 г.). Он же впервые подразделил эти вены на: прямые, соединяющие основные стволы подкожных вен с глубокими, и непрямые, обеспечивающие связь притоков подкожных вен с глубокими венозными магистралями. С этого времени в литературе сохраняется терминологическая путаница в отношении вен, связывающих поверхностную и глубокую венозные системы. R. Linton определил прямые перфорантные вены, как вены, связующие поверхностные вены с глубокими, а коммуникантные, как вены, соединяющие поверхностные вены с мышечными. Нередко в литературе и практике термины «перфоранты» и «коммуниканты» считаются равнозначными и употребляются произвольно. В отечественной литературе в настоящее время общепринято считать прямыми коммуникантные вены, впадающие в основные стволы глубоких вен; непрямыми коммуникантные вены, соединяющие поверхностные вены с мышечными притоками глубоких вен. Перфорантными называют отделы коммуникантных вен на уровне прохождения (перфорации) собственной фасции голени. Многие авторы объединяют понятия перфорантных и коммуникантных вен в единую группу внутренних прободающих вен. Начинаясь от поверхности одним или несколькими притоками, после слияния ствол вены проходит через фасцию, впадая в глубокую или мышечную вену самостоятельно, либо разделяясь на ветви. В связи с этим некоторые авторы выделяют соответственно несколько форм коммуникантных вен: простая, сложная, атипичная, ветвящаяся и собирающая. Другие исследователи считают, что вена-перфоратор обеспечивает направленную передачу крови из осей поверхностных вен в глубокие вены с помощью перфорации поверхностного апоневроза. Коммуникантная вена способствует индифферентной диффузии крови между различными осями или участками поверхностных вен в супраапоневротические пространства. При этом подразделение этих вен идет по основным топографическим группам медиальным, латеральным и задним.
В каждой нижней конечности описано до 155 перфорантов, называемых «постоянными» и выявляемых не менее, чем в 75% исследований и оперативных вмешательств, проведенных по поводу варикозной болезни. Связь между подкожными и глубокими венами осуществляется главным образом опосредованно, то есть через мышечные вены. Количество прямых коммуникантных вен на голени колеблется в пределах от 3 до 10. Непрямых коммуникантных вен гораздо больше, чем прямых. Большинство перфорантов расположены вдоль осей «силовых» линий. Такое расположение отвечает функциональной необходимости. Простейший комплекс вены-перфоратора представлен простой веной Coсkett. Она содержит: 1) сегмент супраапоневротический, берущий свое начало в ближайшей оси поверхностной вены; 2) сегмент трансапоневротический, перфорирующий поверхностный апоневроз через больший или меньший просвет, позволяющий в ряде случаев обеспечить проход совместно с веной артериолы и ветви нерва; 3) сегмент субапоневротический, весьма быстро заканчивающийся в ближайшей оси глубокой вены; 4) клапанный аппарат, классически включающий 1-2 супра-апоневротических клапана, 1-3 субапоневротических клапана, обязательным элементом которых является наличие прикрепительного кольца, соответствующего утолщению венозной стенки.
Вариабелен и диаметр коммуникантных вен. По различным данным в норме он колеблется от 0,1 до 4 мм. При патологических процессах эктазия коммуникантных вен может достигать 7 — 8 и более мм. С точки зрения практической хирургии, наиболее приемлема на наш взгляд классификация французской флебологической школы. Они разделяют перфорантные вены на минимальные (1-1,5 мм), средние (2-2,5 мм) и объемные (3-3,5мм). Термин мегавена применяется для сосудов диаметром более 5 мм. Их называют также перфорационными, комиссуральными и коммуникационными венами.
Благодаря последним анатомическим, ультразвуковым и эндоскопическим исследованиям венозной системы нижних конечностей, появилась возможность отчетливо распознавать венозные клапаны, которые имеют вид прозрачной вуали и способны сопротивляться мощным гемодинамическим ударам мышечных насосов. Количество, локализация и направленность створок клапанных структур вен также достаточно вариабельны. Утверждение, что все вены, связующие поверхностную и глубокую венозные системы имеют клапаны, пропускающие кровь только в глубину не может быть признано абсолютно достоверным, так как выявлены бесклапанные перфорантные вены на стопе и голени. В венах голени также имеются клапаны, створки которых ориентированы в сторону поверхностных вен в одних случаях и в обратном направлении — в других. Пассивно функционируя в зависимости от направленности кровотока, клапанный аппарат вен нижних конечностей предотвращает ретроградный сброс крови, защищая венулы и капилляры от резкого перепада давления при работе мышечно-венозных механизмов стопы, голени и бедра. Отсюда и взаимная обусловленность локализации и функции клапанов.
Значительная вариабельность строения поверхностной венозной сети нижних конечностей усугубляется разночтением в названиях вен и присутствием большого количества эпонимов (фамилий авторов, их описавших), особенно в наименованиях перфорантных вен. Для устранения таких разночтений и создания унифицированной терминологии вен нижних конечностей в 2001 году в Риме был создан Международный междисциплинарный консенсус по венозной анатомической номенклатуре. Согласно ему все вены нижних конечностей условно подразделяются на три системы:
1. Поверхностные вены
2. Глубокие вены
3. Перфорантные вены.
Поверхностные вены лежат в промежутке между кожей и глубокой (мышечной) фасцией. БПВ при этом находится в своем собственном фасциальном футляре, образованным расщеплением поверхностной фасции. Ствол МПВ также находится в собственном фасциальном футляре, наружная стенка которого представляет собой поверхностный листок мышечной фасции. Поверхностные вены обеспечивают отток примерно 10% крови от нижних конечностей. Глубокие вены расположены в пространствах, располагаемых глубже этой мышечной фасции. Кроме этого, глубокие вены всегда сопровождают одноименные артерии, чего не бывает с поверхностными венами. Глубокие вены обеспечивают основной дренаж крови – 90% всей крови от нижних конечностей оттекает по ним. Перфорантные вены прободают глубокую фасцию, соединяя при этом поверхностные и глубокие вены. Термин «коммуникантные вены» оставлен для вен, соединяющих между собой те или иные вены одной системы (т.е. или поверхностные между собой, или глубокие между собой).
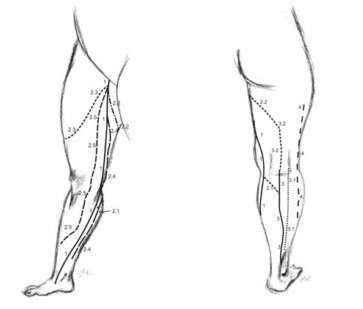
Рис. 5. Поверхностные вены нижних конечностей
Основные поверхностные вены:
1. Большая подкожная вена (БПВ) – vena saphena magna, в англоязычной литературе – great saphenous vein (GSV). Своим истоком имеет медиальную краевую вену стопы. Идет кверху по медиальной поверхности голени, а затем бедра. Дренируется в БВ на уровне паховой складки. Имеет 10-15 клапанов. Поверхностная фасция расщепляется на два листка, образуя канал для БПВ и кожных нервов. На бедре ствол БПВ и его крупные притоки по отношению к фасции могут принимать три основных типа взаиморасположения:
i-тип, при котором ствол БПВ целиком лежит субфасциально от сафено-феморального соустья до коленного сустава.
h-тип, при котором ствол БПВ сопровождает крупный приток, расположенный надфасциально. В определенном месте он прободает фасцию и впадает в БПВ. Дистальнее этого места ствол БПВ, как правило, значительно меньшего диаметра, чем его приток.
s-тип, крайняя степень h-типа, при этом ствол БПВ дистальнее места впадения притока аплазирован. При этом создается впечатление, что ствол БПВ в какой-то момент круто меняет направление, прободая фасцию.
Имеющийся фасциальный канал многими авторами рассматривается как защитный наружный «чехол», предохраняющий ствол БПВ при повышении давления в нем, от чрезмерного растяжения.
Наиболее постоянные притоки:
Межсафенная (ые) вена (ы) (vena(e)) intersaphena(e) в англоязычной литературе – intersaphenous vein(s) – идёт (идут) по медиальной поверхности голени. Соединяет между собой БПВ и МПВ. Часто имеет связи с перфорантными венами медиальной поверхности голени.
Задняя окружающая бедро вена (vena circumflexa femoris posterior), в англоязычной литературе – posterior thigh circumflex vein. Может иметь своим истоком МПВ, а также латеральную венозную систему. Поднимается из задней части бедра, обвивая его, и дренируется в БПВ.
Передняя окружающая бедро вена (vena circumflexa femoris anterior), в англоязычной литературе – anterior thigh circumflex vein. Может иметь своим истоком латеральную венозную систему. Поднимается по передней поверхности бедра, огибая его, и дренируется в БПВ.
Задняя добавочная большая подкожная вена (vena saphena magna accessoria posterior), в англоязычной литературе – posterior accessory great saphenous vein (сегмент этой вены на голени называется задняя арочная вена или вена Леонардо). Так называется любой венозный сегмент на бедре и голени идущий параллельно и кзади от БПВ.
Передняя добавочная большая подкожная вена (vena saphena magna accessoria anterior), в англоязычной литературе – anterior accessory great saphenous vein. Так называется любой венозный сегмент на бедре и голени идущий параллельно и кпереди от БПВ.
Поверхностная добавочная большая подкожная вена (vena saphena magna accessoria superficialis), в англоязычной литературе – superficial accessory great saphenous vein. Так называется любой венозный сегмент на бедре и голени идущий параллельно от БПВ и поверхностнее относительно её фасциального футляра.
Паховое венозное сплетение (confluens venosus subinguinalis), в англоязычной литературе – confluence of superficial inguinal veins. Представляет собой терминальный отдел БПВ возле соустья с БВ. Сюда кроме перечисленных последних трех притоков, впадают три достаточно постоянных притока: поверхностная надчревная вена (v.epigastrica superficialis), наружная срамная вена (v.pudenda externa) и поверхностная вена, окружающая подвздошную кость (v. circumflexa ilei superficialis). В англоязычной литературе существует давно устоявшийся термин Crosse обозначающий этот анатомический сегмент БПВ с перечисленными притоками.
Малая подкожная вена (vena saphena parva), в англоязычной литературе – small saphenous vein. Имеет своим истоком наружную краевую вену стопы. Поднимается по задней поверхности голени и впадает в подколенную вену чаще всего на уровне подколенной складки.
Принимает следующие притоки:
Поверхностная добавочная малая подкожная вена (vena saphena parva accessoria superficialis), в англоязычной литературе — superficial accessory small saphenous vein. Идёт параллельно со стволом МПВ над поверхностным листком её фасциального футляра. Часто самостоятельно впадает в подколенную вену.
Краниальное продолжение малой подкожной вены (extensio cranialis venae saphenae parvae), в англоязычной литературе cranial extension of the small saphenous vein. Ранее называлась бедренно-подколенной веной (v. femoropoplitea). Является рудиментом эмбрионального межвенозного анастомоза. Когда имеется анастомоз между этой веной и задней окружающей бедро веной из системы БПВ, она носит название вена Джиакомини.
Латеральная венозная система (systema venosa lateralis membri inferioris), в англоязычной литературе – lateral venous system. Расположена по латеральной поверхности бедра и голени. Предполагается, что она является рудиментом существовавшей в эмбриональный период системы латеральной маргинальной вены.
Несомненно, что перечислены и имеют собственные имена только основные клинически значимые венозные коллекторы. Учитывая высокое разнообразие строения поверхностной венозной сети, прочие не вошедшие сюда поверхностные вены следует называть по их анатомической локализации. Глубокие вены, как уже указывалось, расположены глубже мышечной фасции и часто сопровождают одноименные артерии.
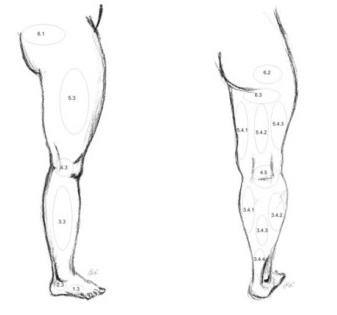
Рис. 6. Перфорантные вены латеральной и задней поверхностей нижних конечностей
Перфорантные вены – одна из самых многочисленных и разнообразных по форме и строению венозных систем. В клинической практике часто называются по фамилиям авторов, причастных к их описанию. Это не только неудобно и тяжело для запоминания, но иногда и исторически не совсем корректно. Поэтому в приведенном международном консенсусе предлагается называть перфорантные вены по их анатомической локализации.
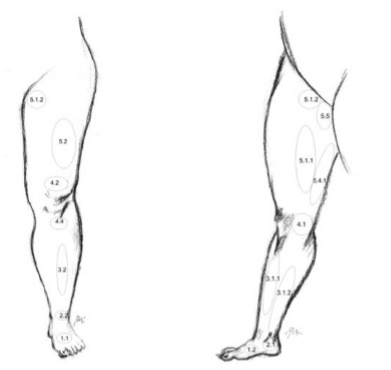
Рис. 7. Перфорантные вены передней и медиальной поверхностей нижних конечностей
Таким образом, все перфорантные вены нижних конечностей следует разделить на 6 групп, которые разбиты на подгруппы:
1. Перфорантные вены стопы
1.1. дорсальные перфорантные вены стопы
1.2. медиальные перфорантные вены стопы
1.3. латеральные перфорантные вены стопы
1.4. плантарные перфорантные вены стопы
2. Перфорантные вены лодыжки
2.1. медиальные перфорантные вены лодыжки
2.2. передние перфорантные вены лодыжки
2.3. латеральные перфорантные вены лодыжки
3. Перфорантные вены голени
3.1. медиальные перфорантные вены голени
3.1.1. паратибиальные перфорантные вены
3.1.2. заднебольшеберцовые перфорантные вены
3.2. передние перфорантные вены голени
3.3. латеральные перфорантные вены голени
3.4. задние перфорантные вены голени
3.4.1. медиальные икроножные перфорантные вены
3.4.2. латеральные икроножные перфорантные вены
3.4.3. междуглавые перфорантные вены
3.4.4. параахиллярные перфорантные вены
4. Перфорантные вены области коленного сустава
4.1. медиальные перфорантные вены области коленного сустава
4.2. наднадколенниковые перфорантные вены
4.3. перфорантные вены латеральной поверхности коленного суста- ва
4.4. поднадколенниковые перфорантные вены
4.5. перфорантные вены подколенной ямки
5. Перфорантные вены бедра
5.1. Медиальные перфорантные вены бедра
5.1.1. Перфорантные вены приводящего канала
5.1.2. Перфорантные вены паховой области
5.2. Перфорантные вены передней поверхности бедра
5.3. Перфорантные вены латеральной поверхности бедра
5.4. Перфорантные вены задней поверхности бедра
5.4.1. Перфорантные вены заднее-медиальной поверхности бе- дра
5.4.2. Седалищные перфорантные вены
5.4.3. Перфорантные вены заднее-латеральной поверхности бе- дра
5.5. Срамные перфорантные вены
6. Перфорантные вены ягодиц
6.1. Верхние ягодичные перфорантные вены
6.2. Средние ягодичные перфорантные вены
6.3. Нижние ягодичные перфорантные вены
2.3. Физиология венозного оттока из нижних конечностей.
Венозная система человека находится под постоянным влиянием гравитационного поля Земли. В горизонтальном положении тела человека вектор силы тяжести направлен практически перпендикулярно оси конечности и её магистральных вен, что нивелирует его действие на флебогемодинамику. При вертикальном положении человека, вектор силы тяжести становится направленным против тока крови. Давление крови, возникающее при сокращении левого желудочка сердца, в большей мере расходуется на прохождение артериального и капиллярного русла, и лишь небольшая его часть передается венозной крови.
Следует условно говорить о центральных и периферических механизмах венозного возврата. К центральным механизмам можно отнести деятельность сердца, легких и диафрагмы, функционирующих в тесном взаимодействии. К периферическим механизмам – реактивность и состояние венозных сосудов, тонус окружающих тканей, деятельность мышечного насоса и мышечно-венозной помпы.
В посткапиллярном русле давление крови составляет 15-20 мм.рт.ст., а в венулах -12-15 мм.рт.ст., что соответствует давлению в венозной системе в горизонтальном положении. Давление крови в венах на уровне лодыжки, в ортостазе, напрямую зависит от роста и составляет 80 — 100 мм.рт.ст. (Швальб П.Г., 2009).
Возросшее венозное давление в неподвижном ортостазе создает препятствия для оттока крови. Устранить это препятствие возможно только путем воздействия, приложенного к венозной системе извне. На уровне капилляров для этого существует так называемый мышечный насос, описанный в трудах В.Т.Назарова (1986) и Н.И.Аринчина (1988). Суть его работы можно наглядно представить следующим образом: неподвижно закрепим отдельно взятую мышцу за сухожилия на противоположных её концах. Затем следует растянуть её за сухожилия в разные стороны. Поскольку сухожильные волокна вплетаются в мышечные, нагрузка будет почти равномерно распределена на всю мышцу. При сокращении мышечные волокна сдавят находящиеся в ней капилляры и другие мелкие сосуды. При этом кровь выдавится из мышцы по направлению к отводящей вене. Теперь отпустим сухожилия, и мышца, благодаря своей эластичности, приобретет первоначальную форму. Внутри её сосудов образуется вакуум, благодаря чему они моментально заполнятся кровью. Причем, обратный ток крови из вен будет затруднён, за счет наличия в них клапанов. Поэтому мышца будет заполняться кровью из артериального конца. Если начать ритмично производить растягиваниерасслабление данной мышцы, то она будет работать как насос, перекачивая кровь от артериального конца к венозному. В экспериментах показано, что скелетная мышца представляет собой весьма мощный насос и способна создавать «на выходе» давление в 200 и более мм. рт. ст.. При этом насосная функция мышц возникает не только при ритмических сокращениях, но и при статическом напряжении. Поскольку мышечный аппарат неподвижно стоящего человека находится в постоянном тоническом напряжении, а для удержания равновесия человек производит непроизвольные малозаметные движения, можно считать, что этот механизм ответственен за длительную по времени компенсацию оттока крови в неподвижном ортостазе. Однако обеспечить полную компенсацию венозного оттока в длительном неподвижном ортостазе он не в состоянии. Для обеспечения нормальной перфузии тканей необходимо, чтобы давление в венозном конце русла стало ниже существующего на артериальном конце – т.е. ниже 35 мм. рт. ст.. Для этого необходимо включение в работу так называемой мышечной венозной помпы. При переходе к ходьбе эти механизмы совместно обеспечивают быстрое снижение давления венозной крови у лодыжки с 85 до 25 мм. рт. ст. и перекачивает порядка 75% крови от нижних конечностей. Действие мышечной венозной помпы похоже на работу описанного мышечного насоса. Различие заключается в размерах сосудов, сдавливаемых мышечными волокнами. Если в первом случае речь идёт преимущественно о мелких сосудах, то во втором случае мышечный массив икроножной, камбаловидной и длинной малоберцовой мышц сдавливают венозные синусы. Последние представляют собой своего рода «мешки» веретенообразной формы, заполняемые венозной кровью. Средний объём всех венозных синусов голени составляет 45 см3. При мышечном сокращении объемы крови, содержащиеся в них, получают ускорение и выбрасываются в бассейн подколенной вены. При мышечном расслаблении венозные клапаны не дают синусам заполняться кровью из вышележащих отделов. Кроме мышечной венозной помпы голени выделяют венозную помпу стопы, которая вносит определённый вклад в обеспечении оттока крови по венам нижних конечностей.
Учитывая, что непременной составной частью мышечной венозной помпы является фасциальный футляр, мы решили установить, является ли фасциальный футляр подкожных вен, в частности БПВ, составной частью механизма оттока по этим венам. Исследовав при помощи ультразвукового ангиосканирования нижних конечностей 28 человек (54 конечности), в положении стоя и при имитации ходьбы, была выявлена зависимость между диаметром БПВ и степенью натяжения поверхностной фасции. При попеременном натяжении и расслаблении фасциального футляра, окружающего БПВ, кровь из сегмента вены вытесняется по направлению к сафено-феморальному соустью. Таким образом, была выявлена активная гемодинамическая функция фасциального футляра БПВ. Обнаруженный механизм был назван «поверхностной венозной помпой».
В работе описанных механизмов существенную роль играют венозные клапаны. Изучить биомеханику их работы удалось лишь совсем недавно, с появлением ультразвукового оборудования с возможностью прямой визуализации движения крови без использования эффекта Допплера (режим B-flow). Исследования американского ученого F.Lurie (2003) показали, что в работе венозных клапанов существует цикл из четырех фаз. На продольном срезе венозные клапаны похожи на воронку, обращенную суженой частью по направлению к сердцу. Эта суженная часть представляет собой створки с тончайшими вуалеобразными выростами, которые колеблются внутри сосуда подобно полотнищу на ветру. Они крайне чувствительны к давлению, создаваемому вокруг. При придании потоку крови ускорения (за счет любых механизмов), створки клапанов расходятся в стороны и между ними (за счет меньшей площади просвета) возникает струя крови, движущейся с высокой скоростью (фаза открытия). Створки клапанов расходятся до определенного расстояния, пока за ними не возникнет вихреобразный поток, который начинает «кружить» в клапанном синусе. Этот вихревой поток создает давление на створки, заставляя их двигаться навстречу друг другу (т.е. закрываться). Пока давление на створки со стороны просвета сосуда и со стороны клапанного синуса динамически друг друга уравновешивают, створки клапана остаются открытыми (равновесная фаза). Но постепенно ускорение исчезает, а с ним падает и скорость движение крови. Давление на створки со стороны клапанных синусов становится больше (фаза закрытия). Клапан закрывается, пока кровь не получит следующий импульс (фаза закрытого клапана).
Существует взгляд (Швальб П.Г., 2009), что наиболее важным для обеспечения адекватного венозного оттока в ортостазе является величина так называемого венозного сопротивления. Введение понятия венозного сопротивления позволяет с иных позиций рассмотреть некоторые вопросы патогенеза ХВН. В частности, это понятие позволяет интегрально соединить два таких, казалось бы, противоположных явления, как увеличение площади венозного русла при варикозной болезни и уменьшение его при посттромботической болезни, и создать единую гемодинамическую концепцию развития ХВН.
Тем не менее ни у кого не вызывает сомнения, что обеспечить адекватный отток крови от нижних конечностей в вертикальном положении возможно только за счет механизмов, действующих во время движения конечностями, придающих ускорение потоку крови. Как изменяются эти механизмы при нарушениях венозного кровотока в различных отделах венозной системы — остается пока недостаточно изученным.
Глава 3. Современный взгляд на проблемы патогенеза варикозного расширения вен нижних конечностей.
В настоящее время в отечественной и зарубежной литературе происходит переосмысление классических взглядов на многие вопросы патогенеза, диагностики и лечения хронических заболеваний венозной системы нижних конечностей. Научно-технический прогресс обуславливает появление новых высокоточных методов клинических и научных исследований. Патогенез варикозной трансформации вен изучается на клеточном и молекулярном уровнях. Ведется поиск маркеров патологической перестройки вен в крови. Результаты современных исследований в области патофизиологии венозных нарушений убедительно показывают ключевое значение клеточной дисфункции в развитии и прогрессировании варикозной болезни. Нарушение функций эндотелия сосудистой стенки, ее повреждение продуктами метаболизма активированных лейкоцитов, постепенная трансформация репаративных процессов, сопровождающаяся стойким изменением структуры и функции гладкомышечных клеток, являются основными звеньями патогенеза нарушений венозного оттока (В.С.Савельев, 2001; Ю.Л. Шевченко, 2005).
Понимание и изучение функции эндотелия началось с работ австралийского патолога Г. Флори в 1945 г., которые послужили основой сегодняшних представлений об эндотелии – ткани, ответственной за сопряжение множества процессов в системе кровообращения. Эти исследования привели к пониманию молекулярных причин патогенеза многих сосудистых заболеваний. Возникло особое понятие (по сути новая клиническая форма) – эндотелиальная дисфункция (J.R. Vane, 1990).
Дальнейшие исследования позволили сделать вывод: эндотелий – это не только внутрисосудистый клеточный слой, обеспечивающий процессы диффузии между кровью и окружающими тканями, но и огромный эндокринный орган, активно участвующий в основных процессах регуляции жизнедеятельности организма.
Исследования последних 10–15 лет существенно изменили представление о роли эндотелия сосудов в общем гомеостазе. Оказалось, что эндотелий синтезирует огромное количество биологически активных веществ (БАВ), играющих весьма важную роль во многих процессах в норме и при патологии (гемодинамике, гемостазе, иммунных реакциях, регенерации и др.). Наличие такой обширной эндокринной активности у эндотелия дало основание назвать его эндокринным деревом.
Эндотелиоциты обладают выраженной метаболической активностью. Барьерная роль эндотелия сосудов, как активного органа, определяет его главную роль в организме человека: поддержание гомеостаза путем регуляции равновесного состояния противоположных процессов – а) тонуса сосудов (вазодилатация/вазоконстрикция); б) анатомического строения сосудов (синтез/ингибирование факторов пролиферации); в) гемостаза (синтез и ингибирование факторов фибринолиза и агрегации тромбоцитов); г) местного воспаления (выработка про- и противовоспалительных факторов) (G.W. Dorn, 1992; J.P. Cooke, 1994)
В постоянной регуляции сосудистого тонуса основную роль играют оксид азота (NO) и эндотелиальный гиперполяризующий фактор (EDHF), в то время как простациклин образуется преимущественно при стимуляции гуморальными факторами, такими как брадикинин, ацетилхолин, а также при увеличении напряжения сдвига. Оксид азота синтезируется эндотелием и является сигнальной молекулой в сердечнососудистой системе – реакция сосудов определяется степенью образования NO (Vane J.R., 1990).
Биологические эффекты NO включают: вазодилатацию, ингибирование адгезии и агрегации тромбоцитов, подавление адгезии моноцитов и лейкоцитов к эндотелию. Оксид азота также снижает пролиферацию гладкомышечных клеток, обеспечивает обезвреживание свободных радикалов, ингибирует окисление липопротеинов низкой плотности (рис.8).
Кроме эндотелий-зависимой вазодилатации, выделяют также и механизм эндотелий-зависимой вазоконстрикции, связанный с синтезом в эндотелии эндотелина-1 и 20-гидроксиэйкозотетраеновой кислоты (20НЕТЕ).
Под эндотелиальной дисфункцией (ЭД) подразумевается истощение и/или дисбаланс выработки эндотелием биологически активных веществ под действием различных эндогенных и экзогенных повреждающих факторов, приводящие к ослаблению или извращению адекватного ответа эндотелиальных клеток на обычные стимулы.
Рис. 8. Биологические эффекты оксида азота (NO).
В клинической практике функциональную активность эндотелия оценивают преимущественно с помощью инструментальных методов. Для регистрации динамики изменения кровотока в различных сосудистых бассейнах используют, главным образом, ультразвуковую допплерографию. Для оценки динамики тканевой перфузии применяют высокочастотную ультразвуковую допплерографию или лазерную допплерографию. Иногда при исследовании эндотелий-зависимой реакции используют метод окклюзионной плетизмографии.
Другим методом оценки выраженности ЭД является лабораторная диагностика – оценка содержания в крови различных веществ, образующихся в эндотелии.
Еще одним методом косвенной оценки состояния эндотелия является исследование содержания в крови факторов, повреждающих эндотелий, уровень которых коррелирует с эндотелиальной дисфункцией. К таким факторам (медиаторам повреждения эндотелия) относятся:
- гипергомоцистеинемия;
- асимметричный диметиларгинин (ADMA);
- липопротеин (а);
- ксантиноксидаза;
- цитокины ( ИЛ-1β, α-ФНО, ИЛ-8 и др.).
Таким образом, можно выделить несколько вариантов изменения функ-циональной активности эндотелия:
- дисфункция эндотелия (изменения концентрации NО, простациклина);
- стимуляция эндотелия (повышение содержания в крови фактора Виллебранда;
- Р- селектина, тканевого активатора плазминогена);
- активация эндотелия (повышение содержания в крови NО, простациклина, фактора Виллебранда, Р-селектина, тканевого активатора плазминогена, эндотелина-1, ICAM-1, VCAM-1, Е-селектина);
- повреждение эндотелиоцитов (повышение содержания в крови тканевого фактора, t-PA, тромбомодулина, рецептора протеина С, фактора Виллебранда, Р-селектина, тканевого активатора плазминогена, а также циркулирующих (десквамированных) эндотелиоцитов).
Как правило, в конкретной клинической ситуации имеется сразу несколько вариантов изменения функциональной активности эндотелия, поэтому в крови присутствуют самые различные эндотелиальные факторы.
Решающую роль в патологических изменениях сосудов при хронической венозной недостаточности (ХВН) Р.Е. Сhаbrier (1995) отводит факторам роста – полипептидным химическим агентам, вырабатывающимся in situ клетками стенки сосуда (эндотелиальными, гладкомышечными клетками) и клетками крови (тромбоцитами, лейкоцитами).
Ключевым моментом возникновения цепи реакций перестройки венозных стенок является адгезия и миграция воспалительных клеток через эндотелий вен.
Таким образом, процессы дисфункции и дисрегуляции эндотелия, повреждения структуры венозной стенки продуктами метаболизма активированных лейкоцитов, гипертрофии венозной стенки в результате фенотипической модуляции гладкомышечных клеток являются основными звеньями патогенеза варикозной трансформации вен.
Патогенетическое значение дисфункции эндотелия при варикозной болезни было исследовано нами у 85 пациентов.
Исследование числа ЦЭК у больных внутрикожным и сегментарным подкожным варикозом без патологического вено-венозного сброса было проведено у 38-и пациентов. ЭД наблюдалась у 19-и больных (50%) данной группы. Среднее число ЦЭК было 3,8±0,6х104, при наличии ЭД – 5,5±0, 5х104 клеток в мл крови. Наличие ЭД у таких больных позволило считать данную форму заболевания начальными проявлениями хронической венозной гипертензии нижних конечностей (ХВННК).
Среди пациентов с сегментарным варикозом и рефлюксом по поверхностным и перфорантным венам дисфункция эндотелия имелась у всех пациентов (100%). Среднее число ЦЭК было 6,8±0,4х104 клеток в мл крови. При сопоставлении результатов исследования уровня эндотелемии с данными ультразвукового сканирования оказалось, что максимальные уровни ЦЭК крови (до 16х104 клеток в мл) отмечалось у больных с сегментарной несостоятельностью магистральных поверхностных вен. Таким образом, ЭД наблюдалась у большинства больных начальными стадиями варикозной болезни и свидетельствовала об активном характере протекания процессов варикозной трансформации вен.
Уровень эндотелемии у больных распространенным варикозом и рефлюксом по поверхностным и перфорантным венам превышал норму у 26,4% пациентов. Среднее число ЦЭК было 2,6±0,6х104 клеток в мл крови у больных без ЭД, и 5,2±0,6х104 клеток в мл крови у больных с ЭД. Таким образом, для запущенных стадий варикозной болезни ЭД менее характерна. Наличие трофических расстройств кожи и мягких тканей голени также не ассоциировалось с повышенной эндотелемией. Ни у одного из больных с трофическими язвами голеней ЭД, по данным исследования числа ЦЭК, в периферической крови не было. В последующих морфогистологических исследованиях удаляемых во время оперативных вмешательств варикозных вен у больных декомпенсированными формами варикозной болезни мы обнаружили частичное объяснение такой ситуации. На фоне выраженных склеротических изменений венозной стенки эндотелиальный слой на протяжении достаточно больших участков отсутствовал. Повреждение и слущивание основной части эндотелиального покрова произошло на более ранних стадиях болезни. Все это дает возможность сделать вывод, что патологический процесс в запущенных случаях «смещается» в сторону нарушений процессов микроциркуляции, нарастания склеротических изменений венозной стенки. Вследствие этого ЭД у многих больных варикозной болезнью в стадии декомпенсации венозного оттока не обнаруживается, хотя повреждение эндотелия сохраняется.
Большинство больных с распространенным варикозом, у кого ЭД все-таки имелась, отмечали прогрессирование заболевания за последние полгода-год в виде усиления болевого синдрома, отечности, а также появления новых участков варикозного расширения вен. Как и при II форме заболевания, характерной особенностью больных с выраженной ЭД (до 10х104 клеток в мл крови) было наличие несостоятельности клапанов магистральных поверхностных вен. При этом, хотя ретроградный кровоток и был патологическим, его временные и скоростные показатели были не столь значительны, что свидетельствовало об активном течении процессов варикозной трансформации этих вен.
Наличие несостоятельности глубоких вен нетромботического генеза также не было связано с повышенным уровнем эндотелемии. В большинстве случаев (80%) у больных сочетанной формой заболевания уровень ЦЭК был в пределах нормы и составлял в среднем 2,8±0,5х104 клеток в мл крови. Происходит это, по всей видимости, по тем же причинам, что и при распространенном варикозе
Результаты, полученные нами при обследовании больных рецидивами варикозного расширения вен, имели закономерности, схожие с первичными случаями. ЭД определялась у большинства больных малыми рецидивами (80%) и у незначительной части больных большими рецидивами (28,6%).
Более высокий уровень эндотелемии у больных декомпенсированными формами варикозной болезни «настораживал», в результате чего проводидось тщательное обследование другой конечности. Во всех случаях на противоположной конечности выявлялись признаки начальных стадий варикозной болезни. А в ряде случаев начальные изменения варикозной трансформации вен удвалось обнаружить на «доклинической» стадии.
При статистическом анализе связи показателя ЭД с различными факторами было использовано 32 признака, включая пол, возраст, давность и форму заболевания, виды нарушения гемодинамики и др. Статистически значимые различия были обнаружены между показателями уровня эндотелемии и давностью заболевания до 5 лет (р<0,001), возрастом больного до 30 лет (р<0,05), формой варикозной болезни (р<0,05), неинтенсивным рефлюксом по магистральным поверхностным венам (р<0,05).
В раннем и позднем послеоперационном периоде исследование уровня эндотелемии было произведено у 64 больных. Дисфункция эндотелия в раннем послеоперационном периоде наблюдалась у большинства больных (68,6%), без связи с исходным уровнем эндотелемии. Это объяснялось неизбежным травмированием стенок венозных сосудов при их удалении, появлением локальных участков флеботромбозов в области разрушенных притоков вен и др. Вследствие этого, сохранению повышенного уровня числа ЦЭК в крови в течение 1 месяца после оперативного лечения особой важности мы не придавали. По истечении этого срока проявлений дисфункции эндотелия у большинства больных не было.
Лишь у части больных декомпенсированными формами варикозной болезни (23,5%) уровень эндотелемии оставался высоким. У всех этих больных на противоположной конечности имелась та или иная форма варикозной болезни, некоторое прогрессирование симптомов которой неизбежно происходило в условиях, когда больной щадил оперированную ногу. Для коррекции дисфункции эндотелия у таких больных с успехом применялись венотоники, компрессионный трикотаж, а также аппаратная пневмокомпрессия, которая оказалась очень эффективной.
Таким образом, дисфункция эндотелия у больных варикозной болезнью была значительно более выражена при начальных стадиях заболевания. В случаях декомпенсированных форм варикозной болезни, уровень ЦЭК повышался в периоды прогрессирования варикозной трансформации вен. Число ЦЭК в периферической крови может использоваться как маркер дисфункции эндотелия при заболеваниях периферических вен.
С целью оценки динамики изменений специфических маркеров эндотелиальной дисфункции во время операции при варикозной болезни и в процессе последующей нормализации флебогемодинамики, нами изучены изменения уровня сосудистой молекулы адгезии 1 (VCAM-1), а также Р- и Е-селектинов. Выбор этих показателей продиктован рядом факторов.
Эндотелины – семейство пептидов, влияющих на тонус гладкомышечных клеток сосудов. Идентифицировано три представителя семейства эндотелинов (ЭТ-1, ЭТ-2 и ЭТ-3), очень близких между собой по структуре. В эндотелии синтезируется только эндотелин-1. Эндотелин-1 не накапливается в эндотелиальных клетках, но очень быстро образуется под воздействием многих факторов: адреналина, ангиотензина-II, вазопрессина, тромбина, цитокинов и механических воздействий. Из эндотелия выделяется малоактивный большой ЭТ-1, который на мембране гладкомышечной клетки превращается в ЭТ-1. Однако большая часть ЭТ образуется в самом эндотелии, после чего происходит его секреция в кровь.
На эндотелии представлены Р- и Е-селектины, которые связываются с сиалированными гликопротеинами мембраны лейкоцитов. Другая группа эндотелиальных молекул адгезии – сосудистая клеточная молекула адгезии (VCAM-1, vascular cellular adhesion molecule 1) – относится к семейству иммуноглобулинов и связывается с интегринами мембраны лейкоцитов. Стимуляция эндотелия или его повреждение приводят к дополнительной экспрессии молекул адгезии – селектинов и VCAM-1. Это вызывает адгезию лейкоцитов, которая проходит в две стадии: стадия роллинга (прокатывания лейкоцитов вдоль эндотелия) и стадия плотной адгезии (остановки лейкоцитов).
Повышение адгезивности эндотелия имеет большое значение в патогенезе дисфункции эндотелия при воспалении, хронической венозной недостаточности и других патологических процессах.
Проведены исследования изменений ЦЭК, уровня сосудистой молекулы адгезии 1 (VCAM-1), а также Р- и Е-селектинов, эндотелина-1 у 13-и здоровых добровольцев и у 31-го больного варикозной болезнью до операции, через 5 дней и через 30 суток после оперативного вмешательства. Результаты представлены в табл. 1.
Таблица
1 Изменения показателей дисфункции эндотелия у больных,
перенесших оперативное вмешательство по поводу варикозной болезни
| ЦЭК | VCAM | Р-селектин | Е-селектин | ЭТ-1 | |
| До операции | 6,35±2,47 | 7,47±1,13 | 204±22,5 | 44,6±2,42 | 0,54±0,22 |
| Через 5 суток после операции | 11,9±3,71 | 3,03±1,28 | 189±11,7 | 38,4±1,17 | 1,4±0,19 |
| Через 30 суток после операции | 5,29±1,93 | 8,53±2,02 | 178±10,3 | 39,4±2,01 | 0,93±0,14 |
| контроль | 4,59±1,62 | 6,4±1,11 | 184±11,8 | 45,9±1,25 | 0,89±0,11 |
Непосредственно после оперативного вмешательства выявлено существенное повышение уровня ЦЭК (с 6,35±2,47 до 11,9±3,71, р<0,05). Такая реакция очевидно связана с повреждением эндотелия во время оперативного вмешательства.
Несколько другая динамика отмечалась при определении содержания Р- и Е-селектинов, эндотелина-1. На фоне повышения ЦЭК через 5 суток после операции такие показатели, как VCAM-1, Р- и Е-селектины, наоборот уменьшались, в то время как уровень эндотелина-1 повышался. Это, вероятно, также является отражением послеоперационных изменений за счет обширной травмы сосудистого русла – эндотелемия наросла, но функциональность такого эндотелия крайне низкая.
Через 30 суток после операции отмечалось снижение уровня эндотелемии до 5,29±1,93. Отмечалось повышение уровня VCAM-1, в то время как концентрация Е-селектина оставалась практически на прежнем уровне, а Р-селектина даже снижалась. Уровень эндотелина-1 приблизился к значениям, полученным у добровольцев контрольной группы.
Полученные результаты свидетельствуют о существенных изменениях, происходящих в эндотелиоцитах сосудистого русла при хирургической коррекции флебогемодинамики.
Таким образом, рассматривая вопросы патогенеза варикозной трансформации вен, ещё раз необходимо отметить их многогранность и сложность. Ряд исследований реологических свойств венозной крови позволили обнаружить феномен гемоконцентрации у человека в положении стоя и чрезмерное его проявление у пациентов с венозной гипертензией (J.А. Dormandy, 1995). У таких пациентов в среднем 30% циркулирующих лейкоцитов оказывается в «ловушке» или «потеряны» в дистальной части наклоненной (опущенной) ноги в конце часа. При этом лейкоциты располагаются маргинально по периферии кровотока, с чем связано «катание», так называемый роллинг лейкоцитов по длине стенки эндотелия вены со скоростью значительно меньшей, чем у лейкоцитов, циркулирующих свободно.
В варикозно расширенных венах имеется функциональная недостаточность гладкомышечных клеток, связанная с их сократимостью и поддержанием нормального тонуса венозной стенки. Веноконстрикторный ответ у пациентов варикозной болезнью снижен не только в пораженных венах, но и в неизмененных венах верхних конечностей (P. Pacaud, 2003). Дефект локализуется на уровне рецепторного звена. Количество рецепторов к основным видам констрикторов в венозной стенке снижено уже на ранних стадиях заболевания, в частности α–адренорецепторов норадреналина, β-рецепторов эндотелина-1, специфических рецепторов ангиотензина-II. Также имеет значение снижение степени сродства указанных вазомоторных субстанций к соответствующим рецепторам. Недостаточность контрактильной функции гладкомышечных клеток венозной стенки ассоциируется также с повреждением внутриклеточных сигнальных механизмов процесса сокращения миоцитов, связанных прежде всего со снижением Rho-киназной Са2+-сенситизации и дизрегуляцией системы NO-цГМФ. В результате, особенно на фоне дисгормональных изменений, в венозной стенке возникает дисбаланс вазоактивных факторов в сторону венодилятации, что может рассматриваться как один из возможных механизмов развития первичного варикоза.
Гипоксия венозной стенки является важнейшим пусковым механизмом сосудистого ремоделирования. Ее губительное действие наиболее ярко проявляет себя в условиях нарушения венозного кровотока, в частности при нарушении физиологического «shear»-стресса и повышенном гидростатическом давлении. Венозная система характеризуется наиболее низкими значениями протективного «shear»-стресса (1-10 дин/см2). При снижениях этого показателя и без того «ранимая» венозная стенка оказывается лишенной защитных свойств нормального кровотока. Более того, непосредственными последствиями аномально низкого «shear»-стресса, реализующимися по механизму механотрансдукции, могут быть следующие процессы: усиление экспрессии молекул адгезии, повышение продукции ингибитора фибринолиза PAI-1 и снижение продукции тканевого активатора плазминогена, усиление продукции эндотелина-1 и снижение выработки окиси азота NO и другие механизмы, поддерживающие провоспалительное состояние венозной стенки.
Проведённые нами гистологические исследования стенок вен с помощью электронной микроскопии позволили выявить, при варикозной их трансформации, очаговую дезорганизацию интимальной оболочки, набухание соединительной ткани, денудацию клеток эндотелия, преобладание склеротических процессов. В створках клапанов происходит фиброэластоз, склероз и гиалиноз. В средней оболочке обнаруживается гипертрофия мышечных клеток, атрофия эластических волокон, развитие диффузного склероза.
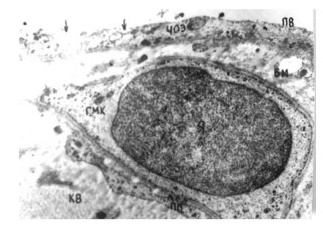
Рис. 9. Нарушение целостности плазматической мембраны на люминальной поверхности цитоплазматического отростка эндотелиоцита (ЦОЭ) (указано стрелками). ГМК – гладкомышечная клетка, ПП – пиноцитозные пузырьки, БМ – базальная мембрана, ПВ – просвет вены, Я – ядро ГМК, ПКВ – пучки коллагеновых волокон (ув. х 6600).
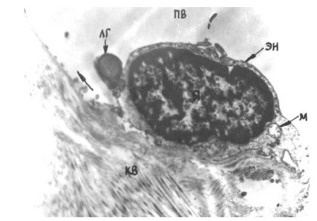
Рис. 10. Ядросодержащая часть эндотелиоцита (ЭН) с признаками десквамации (поверхность створки без эндотелия указана стрелкой). Я – ядро эндотелиоцита, М – митохондрия, ЛГ – липидная глобула, КВ – пучки коллагеновых волокон (увеличение х 8300).
Полиморфные изменения в большей степени затрагивают створки венозных клапанов. Наблюдается ряд характерных проявлений в виде различной степени выраженности дистрофических расстройств. В эндотелиоцитах створок венозных клапанов появляются локальные нарушения целостности плазматической мембраны, участки отека цитоплазмы, деформация органелл, десквамация цитоплазматических отростков эндотелиоцитов (рис. 9).
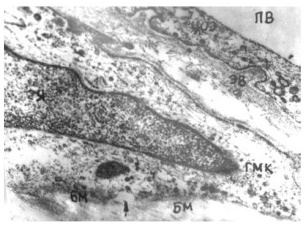
Рис. 11. Цитоплазматический отросток эндотелоцита с признаками отека (разрушенная базальная мембрана гладкомышечной клетки показана стрелками). МКФ – микрофиламенты, ЭВ – эластические волокна (увеличение х 16000).
Пиноцитозная активность гладкомышечных клеток снижена, базальная мембрана разрыхлена, местами прерывается, имеются участки с полным ее отсутствием.
На некоторых участках поверхность клапана вообще лишена эндотелиального пласта и представлена «обнаженной» базальной мембраной с остатками десквамированного эпителия (рис.10).
Под эндотелиальным слоем вблизи базальной мембраны среди микрофибриллярного эластина и пучков коллагеновых волокон располагаются немногочисленные гладкомышечные клетки. Их цитоплазма просветлена, в ней резко уменьшено количество нерегулярно расположенных миофиламентов. Как в центральных, так и в периферических отделах цитоплазмы обнаруживаются цистерны зернистой эндоплазматической сети и другие клеточные органеллы (рис. 11).
При рецидивном варикозном расширении вен нижних конечностей, в зависимости от его причины (техническая погрешность при первичной операции или прогрессирование заболевании), гистологическая картина имеет свои характерные черты. Так в случаях, когда причиной рецидива стала техническая погрешность при выполнении операции (патологическая культя БПВ, неудаленная МПВ и др.), гистологическая картина участков удалённых у таких больных вен имела изменения, характерные для поздних стадий варикозной болезни (склероз, гиалиноз, очаговая дезорганизация соединительной ткани интимы по типу мукоидного набухания, деформирующий рубцовый склероз медии). Если рецидив варикозного расширения возникал как следствие естественного прогрессирования заболевания, то при исследовании удалённых сегментов вен обнаруживали изменения, характерные для начальной стадии варикозной болезни: миоэластоз, миоэластофиброз интимы, интерфасцикулярный фиброз медии (П.Г.Швальб, 2009).
Таким образом, процессы дисфункции и дизрегуляции эндотелия, повреждения структуры венозной стенки продуктами метаболизма активированных лейкоцитов, гипертрофии венозной стенки в результате фенотипической модуляции гладкомышечных клеток являются основными звеньями патогенеза варикозной трансформации вен.
Глава 4. Механизмы воздействия лазерного излучения на венозный комплекс (Совместно с Т.В.Хлевтовой).
Виды лазеров, применяемых для эндовенозной лазерной облитерации
На российском рынке имеется достаточно широкий спектр оборудования, которое можно использовать для проведения ЭВЛО. Многочисленные производители предлагают аппаратуру, отличную как по своим техническим характеристикам, так по цене и дизайну.
К сожалению, не всё имеющееся в продаже лазерное хирургическое оборудование сертифицировано и имеет разрешение на применение для ЭВЛО. Об этом нужно помнить, когда принимается решение о его приобретении. Использование не сертифицированного и не имеющего разрешения на ЭВЛО оборудования может повлечь за собой юридические проблемы и, в конечном итоге, привести к значительным материальным издержкам. В таблице 2 приведена сравнительная характеристика оборудования, которое можно приобрести на отечественном рынке.
Таблица 2 Сравнительная характеристика лазерного хирургического оборудования для ЭВЛО, представленного на отечественном рынке.
 |
Милон-Лахта, производитель группа компаний «Милон», РФ.
Длины волн: 1060 нм, 970 нм. Мощность излучения: до 30 Вт Сертифицирован. |
|||
 |
Яхрома-мед, производитель ФИРАН, РФ.
Длины волн: 511 нм, 578 нм. Мощность: до 5 Вт (для удаления телеангиоэктазий). |
|||
 |
ЛАМИ, производитель ООО «Новые Хирургические Технологии», РФ.
Длины волн: 1040 нм при мощности 25 и 60 Вт, 1552 нм при мощности 10, 15, 20 Вт. Сертифицирован. |
|||
 |
Медилаз фирмы «Дорнье» Германия.
Длина волны: 940 нм. Мощность: 25, 80 Вт. Сертифицирован. |
|||
 |
«Диодерм Эндо» «ИНТЕРМЕДИК» Испания.
Длина волны: 970 нм. Мощность: 30 Вт. |
|||
 |
ЛСП, производитель «ИРЭ-Полюс», РФ.
Длина волны: 970 нм, 1556 нм. Мощность: 15, 30 Вт. Сертифицирован. |
|||
 |
Аппараты, разрабатываемые производителем ООО «Новые Хирургические Технологии», РФ, совместно со специалистами НМХЦ им.
Н.И.Пирогова, специализированы для флебологии. Мощность основного излучения для длины волны 1030 нм до 40 Вт, для 1470 нм до 20 Вт; длина импульса от 0,1 до 10 сек. |
|||
Комплектуются волоконными датчиками температуры, световодными двухволновыми датчиками объемного отражения, которые позволяют контролировать температуру и скорость нагрева крови в вене, а также момент испарения крови, состояние световода, энергию излучения, передаваемую в вену, термические изменения венозной стенки.
Наибольший практический интерес с нашей точки зрения представляет серия специализированных аппаратов, разрабатываемых российским производителем ООО «Новые Хирургические Технологии» совместно со специалистами НМХЦ им. Н.И.Пирогова для применения во флебологии. В аппарате впервые реализован принцип обратной связи. При этом тракция световода осуществляется в автоматическом режиме, что нивелирует субъективный фактор при выполнении ЭВЛО.
Аппарат позволяет контролировать скорость нагрева и момент закипания крови в вене, состояние световода, энергию излучения, передаваемого в вену и соответствующие термические изменения стенки вены. Программное обеспечение аппарата позволяет сохранять все параметры проведенной операции на персональном компьютере. Появление такого оборудования является долгожданным событием для специалистов, использующих технологию ЭВЛО. Отрадно, что такую технологию удалось реализовать отечественному разработчику. Появление в арсенале флеболога лазерного оборудования, с возможностями автоматического контроля процесса ЭВЛО, позволит упростить и стандартизировать процедуру ЭВЛО, а также устранить субъективные факторы в ходе её выполнения.
Единицы измерения
Энергия лазерного излучения в системе СИ измеряется в Джоулях (Дж). Плотность потока энергии лазерного излучения – Дж/см2. Мощность излучения определяется в Ваттах (Вт). 1Вт = 1 Дж/сек. Таким образом, плотность мощности лазерного излучения можно выразить через отношение мощности к площади облучаемой поверхности: Дж/сек х см2 = Вт/см2. Потреблённая энергия излучения, т.е. общая доза энергии за процедуру ЭВЛО = P x N x t/s; где P – мощность излучения (Вт), t – длительность импульса (сек), s – облучаемая площадь (см2), N – число импульсов. Исходя из того, что расчет потребленной энергии в условиях тракции световода внутри сосуда со сложной конфигурацией внутренней поверхности представляется слишком громоздким, в клинической практике часто используют значение Дж/см, т.е. количество энергии, поданное на «погонный» сантиметр вены. Этот параметр не вполне корректно отражает физическую величину потока энергии, однако, благодаря простоте расчета, с некоторыми оговорками вполне уместен для использования в клинике (Fan C.M., 2008).
Физика поглощения энергии лазерного излучения
Биологические ткани содержат вещества, известные как хромофоры, каждое из которых в видимой области спектра поглощает излучение сугубо специфической длины волны (рис.12). Примерами биологических хромофоров служат: меланин, гемоглобин, флавины. В результате поглощения фотона молекула хромофора переходит на более высокий электронный уровень. Затем часть этой энергии теряется в виде флюоресценции, часть – расходуется на нагревание окружающих тканей. Электронно-возбуждённые молекулы хромофора могут вступать во взаимодействие с компонентами тканей и кислородом. В последнем случае возникает так называемый активный кислород, который эффективно разрушает биологические структуры.
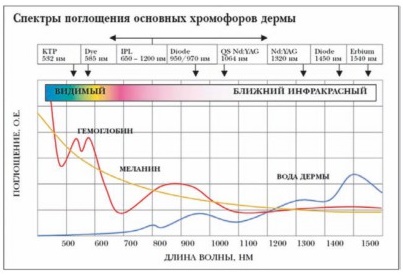
Рис. 12. Спектры поглощения основных хромофоров дермы.
При воздействии инфракрасного излучения его поглощают специфические фоторецепторы (типа воды). При этом поглощение инфракрасного излучения вызывает возбуждение низколежащих, главным образом, колебательных уровней молекул, энергия которых расходуется на нагревание среды без выделения активного кислорода.
Таким образом, при ЭВЛО, поглощение энергии лазерного излучения видимой части спектра происходит, в основном, гемоглобином крови. Для излучения инфракрасной части спектра, основным фоторецептором является вода.
В зависимости от температурного воздействия на живую ткань, в ней происходят различные изменения: при температуре до 40°С (при отсутствии длительного воздействия) необратимых изменений ткани не возникает, при температуре около 60°С начинает происходить коагуляция белков, при температуре свыше 300°С ткань испаряется. Схема эффекта воздействия различной температуры на биоткани приведена в таблице 3. При этом следует учитывать, что продолжительность температурного воздействия также обуславливает эффект на ткани.
Таблица 3 Изменения в биотканях, в зависимости от температуры.
| Температура, °С | Эффект на биоткани | |
| 37 | не возникает необратимых изменений | |
| 40-45 | активация ферментов, образование отёков, изменение мембран, при длительном воздействии – смерть клеток. | |
| 60-80 | денатурация белков, начало коагуляции и образования некрозов | |
| 100 | обезвоживание | |
| 150 и выше | обугливание | |
| 300 и выше | выпаривание, газообразование |
Механизм воздействия лазерного излучения на венозный комплекс
Механизм воздействия лазерного излучения на венозный комплекс включает в себя:
- прямое воздействие лазерного излучения
- воздействие испаряющейся крови
- воздействие перенагретой рабочей части световода
Так как кровь является мутной жидкостью, интенсивно рассеивающей и поглощающей световое излучение, изначально (L. Navarro et al., 2001) считалось, что непосредственного воздействия лазерного излучения на стенку вены практически не происходит.
В апреле 2002 г. в Journal of vascular surgery была опубликована статья Proebstle T.M. с соавт., в которой описана теория воздействия пузырьков пара на интиму вены – как основной механизм ЭВЛО. Авторами в опытах in vitro в силиконовую трубочку, заполненную гепаринизированной кровью, диаметром 6 мм было помещено оптическое волокно. Во время подачи лазерного излучения кровь нагревалась и закипала, образуя пузырьки пара.
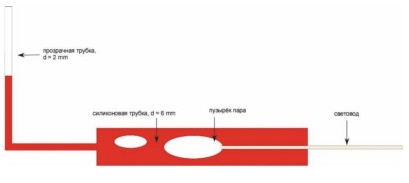
Рис. 13. Опыт T.M. Proebstle и соавт.
Образовавшиеся пузырьки приводили к увеличению объема крови и повышению уровня крови в отводящей трубке диаметром 2 мм. По изменению уровня крови в отводящей трубке был определен объем образующихся пузырьков пара, и выявлена прямая зависимость между количеством подаваемой энергии и объемом пузырьков (рис.13). Описанный феномен приводил к обширным повреждениям эндотелия венозной стенки и был, по мнению авторов, главным повреждающим фактором. Группой этих же ученых (Proebstle T.M. с соавт., 2002) были проведены опыты на БПВ, удаленных по методу Бэбкокка. Лазерному воздействию подвергались 5 БПВ, заполненных раствором NaCl (0.9%), и 5 БПВ, заполненных гепаринизированной кровью. Затем проводилось гистологическое исследование. В венах, заполненных раствором 0,9% NaCl, пузырьки пара не образовывались, и прямое лазер-индуцированое повреждение стенки сосуда было слабо выраженно. В венах, заполненных гепаринизированной кровью, тепловое повреждение эндотелия распространялось на противоположную стенку, и было обширным. Пар регистрировался при применении лазерных аппаратов с длинами волн 810, 940, 980 нм. Результатом исследования явилось выделение ключевой роли крови в просвете вены при реализации ЭВЛО. Proebstle T.M. с соавт. важную роль отводили размерам пузырей пара. По их мнению, размеры должны были соответствовать диаметру сосуда, в котором происходил процесс ЭВЛО, поэтому мощность излучения лазера подбиралась таким образом, чтобы размер пузыря был близок к 6 мм (диаметру трубочки).
Для наглядной демонстрации избирательного поглощения гемоглобином лазерного излучения 1030 нм мы провели следующий опыт: один шприц емкостью 5 мл заполнили гепаринизированной кровью, а другой – физиологическим раствором. В каждый шприц ввели световод и сделали по 5 импульсов, длиной 990 мс, с интервалом 10 мс при мощности излучения 24 Вт. В шприце, заполненном кровью, начиная со второго импульса, возникло “кипение” крови, причём размер пузырьков был соизмерим с размерами шприца (рис. 14). Согласно физическим законам, при кипении размер пузырей должен уменьшаться по мере удаления от источника тепла и в результате контакта с более холодной жидкостью. При этом, достигнув не нагретого слоя жидкости, они должны исчезать. В нашем эксперименте пузыри не только не уменьшались, но и сохраняли свою форму и размер длительное время после выключения лазера. Таким образом, не вызывает сомнения, что пузыри газа, выделяемого при ЭВЛО, не являются водяным паром, как предполагали T.M. Proebstle с соавт.

Рис. 14. Длина волны излучения лазера 1030 нм. В шприце, заполненном кровью, отмечается бурное выделение газа. В шприце, заполненном физиологическим раствором, не отмечается ни кипения, ни значимого подъёма температуры.
Во втором шприце, заполненном физиологическим раствором, кипения не наблюдалось, локального нагрева шприца не отмечалось.
В просвете магистральной вены после ЭВЛО скопления газа сохраняются на протяжении как минимум 30 минут. Еще раз отметим, что такой срок существования водяного пара — нереален. Одновременно, при создании тумесцентной анестезии, вена обжимается вокруг световода, и её внутренний просвет становится близким к диаметру световода. Опыты T.M. Proebstle были основаны на модели вены диаметром 6 мм, поэтому в реальной вене, диаметр просвета которой после создания тумесцентной анестезии близок к 1 мм, могут происходить процессы, отличные от описанных в модели. Прежде всего, пузыри пара должны практически мгновенно передать тепло стенке сосуда и конденсироваться обратно в воду. На практике же, длительное время после ЭВЛО при УЗАС в вене можно обнаружить скопления газа. Если это не пар, то что за газ мы находим в просвете вены (рис.15)?
Температура, создаваемая в просвете вены во время ЭВЛО, зависит от многих параметров, таких как величина энергии излучения, количество и длительность импульсов, диаметр вены, карбонизация оптического волокна, образование газа и др. T.M. Proebstle полагал, что максимальная температура во врепосле ЭВЛО. мя ЭВЛО создаётся  внутри пузырьков пара, и её значение должно составлять около 100°С. Однако, R.A.Weiss и соавт. (2002), в модели in vivo показали, что в просвете вены при ЭВЛО создаётся температура в 729°С, пиковые же значения температуры достигают 1334°С. B. Disselhoff и соавт. (2008), в экспериментальном исследовании (диодный лазер — 810 нм) отмечали создание на торце световода температуры до 1200°С. M.Amzayyb и соавт. (2010), разогрев торца световода при проведении ЭВЛО объясняли образованием тонкого слоя нагара. Нагар интенсивно поглощает энергию излучения, благодаря чему разогревается до экстремально высоких температур. При этом образование нагара и степень разогрева совершенно не зависят от того, какая длина волны используется (810 нм, 940 нм, 1470 нм).
внутри пузырьков пара, и её значение должно составлять около 100°С. Однако, R.A.Weiss и соавт. (2002), в модели in vivo показали, что в просвете вены при ЭВЛО создаётся температура в 729°С, пиковые же значения температуры достигают 1334°С. B. Disselhoff и соавт. (2008), в экспериментальном исследовании (диодный лазер — 810 нм) отмечали создание на торце световода температуры до 1200°С. M.Amzayyb и соавт. (2010), разогрев торца световода при проведении ЭВЛО объясняли образованием тонкого слоя нагара. Нагар интенсивно поглощает энергию излучения, благодаря чему разогревается до экстремально высоких температур. При этом образование нагара и степень разогрева совершенно не зависят от того, какая длина волны используется (810 нм, 940 нм, 1470 нм).
Рис. 15. Газ в просвете БПВ через 20 минут
Таким образом, крайне высокие температуры, создаваемые в просвете вены во время ЭВЛО, также могут воздействовать на интиму вены и иметь значение в последующей облитерации. Уместно вспомнить, что S.Mordon et al., создав в 2006 году математическую модель ЭВЛО, уже тогда поставили под сомнение теорию о пузырях пара, как основном механизме ЭВЛО. Со временем накопились и иные данные, которые заставили нас повторить классический эксперимент образования пузырьков.
В своём эксперименте мы довели площадь сечения модели вены до реального значения, имеющего место во время тумесцентной анестезии. В первой фазе опытов в качестве модели вены мы использовали капилляр Панченкова, внутренний диаметр которого равен 1 мм. Учитывая, что при создании анестезии вена обжимается вокруг световода неплотно, именно такой диаметр просвета должен быть в реальной ситуации, что хорошо заметно на ультразвуковых сканограммах (рис.16). Капилляр Панченкова заполняли гепаринизированной венозной кровью, в просвет вводили световод. Извлечение световода выполняли с помощью специального устройства, обеспечивающего постоянную скорость вытяжения — 1 мм/ сек. Энергетические параметры излучения составляли 5, 7, 10, 12, 20 Дж в одном импульсе для лазера с длиной волны 1030 нм, и 1, 3, 5, 12 Дж – для лазера 1470 нм. Во всех случаях использовали псевдонепрерывный режим с длиной импульса в 1 секунду и интервалом между импульсами – 0,01 сек.
Рис. 16. Просвет большой подкожной вены после ющего постоянную ско-создания тумесцентной анестезии близок к диаметру рость вытяжения — 1 мм/световода и составляет около 1 мм.

Рис. 17. Раскаленный торец световода выпаривает кровь, оставляя сажу на стенках капилляра.
Полное выпаривание крови из капилляра и разогрев торца световода до сверхвысоких температур происходили при достижении линейной плотности потока энергии в 10 Дж/см для лазера 1470 нм и 70 Дж/см для лазера с длиной волны 1030 нм (рис. 17). Учитывая, что в клинике такие параметры излучения являются пороговыми, мы предполагаем, что основное действие обусловлено прямым воздействием лазерного излучения на стенку вены. Образовавшаяся на стенках вены сажа дополнительно интенсивно поглощает это излучение и, разогреваясь, также оказывает температурное воздействие на венозную стенку.
Провести прямую термометрию рабочего торца световода технически очень сложно. Однако, его температуру можно измерить косвенным путём, по цвету его излучения в соответствии со шкалой цветовой температуры. При всех энергетических параметрах, вне зависимости от мощности излучения, мы определяли температуру рабочей части световода в диапазоне от 800 до 2000°С! Причём эта температура постоянно и непредсказуемо менялась, что связано с количеством образующегося на торце нагара.
Из-за значительной разницы температур, при контакте переразогретой части световода с влажной стенкой вены, неизбежно должно возникнуть явление плёночного кипения. Этот феномен обусловлен образованием тонкой прослойки пара (газа) между раскалённым торцом световода и интимой вены. Прослойка пара обладает низкой теплопроводностью, передача тепла от световода к вене резко падает и, если контакт кратковременен, повреждения интимы не возникнет. Для подтверждения этой гипотезы в одной из серий опытов мы ввели в просвет капилляра тонкую (0,2 мм) оловянную проволоку, имеющую температуру плавления 232°С и удельную теплоту плавления 60 кДж/кг (рис.18а). Ни в одном случае мы не получили расплавления проволоки под воздействием раскалённого торца световода (рис.18б).

Рис. 18а. В капилляр по всей длине введена оловянная проволока. При тракции световода раскалённый его торец проходит в непосредственной близости от проволоки.

Рис. 18б. После извлечения из капилляра оловянная проволока покрыта черным нагаром, но не расплавлена.
Результаты исследования показали, что физические явления, происходящие во время ЭВЛО, можно условно разделить на три фазы:
Испарение крови и карбонизация торца световода при подаче первых импульсов. Этот период длится от долей секунды при высоких значениях плотности потока энергии до 5-6 секунд при его минимальных значениях. Под влиянием лазерного излучения и раскалённого до экстремальных температур торца световода происходит выпаривание крови с образованием газа, состоящего из продуктов горения. Сгоревшие органические вещества в виде золы откладываются на интиме. После полного выпаривания вены, её просвет остаётся заполненным газом.
Поскольку вену заполняет не кровь, а прозрачный газ, в эту фазу начинает реализоваться непосредственное воздействие лазерного излучения на венозную стенку. Именно непосредственное воздействие излучения лазера на вену, с нашей точки зрения, является основными фактором в реализации механизма ЭВЛО. От воздействия высокой температуры раскалённого торца световода интиму защищает эффект плёночного кипения.
Если тракции световода не происходит, или она производится слишком медленно, кровь полностью испаряется и эффект плёночного кипения исчезает. С этого момента переразогретая рабочая часть световода начинает оказывать прямое термическое воздействие на вену.
Данный механизм оказался универсальным, т.е. независимым от длины волны лазерного излучения.
Для подтверждения результатов полученных in vitro, мы ещё раз смоделировали процесс ЭВЛО. Для этого БПВ, удалённая во время флебэктомии, была герметизирована (перевязаны все притоки), заполнена гепаринизированной кровью и помещена в прозрачную термоусадочную трубку Raychman™ — PBF™, температура усадки которой составляет 125°С. Диаметр трубки составил 10 мм. В просвет вены введён световод диаметром 600 мкм, вокруг вены создана имитация тумесцентной анестезии раствором желатина. В процессе «тумесценции» вена под влиянием внешнего давления обжималась вокруг световода. В конечном итоге, после окончания «тумесценции» диаметр вены составлял от 3 до 4 мм (изначальный диаметр вены в «расправленном» состоянии был 7-8 мм). После часовой экспозиции препарата при температуре 4°С происходило застывание желатина, и препарат фиксировался в штативе (рис.19).
В рассматриваемой серии опытов энергетические параметры лазерного излучения были аналогичны опытам с капилляром Панченкова.

Рис. 19. Препарат БПВ, помещенный в штатив. Препарат БПВ в штативе, «обжатый» раствором желатина. Отчетливо видно значительное уменьшение диаметра вены. В левой части препарата виден пилотный луч.
Результаты эксперимента полностью подтвердили нашу концепцию о фазности процесса ЭВЛО. Кроме этого, был получен ещё целый ряд важной информации. В частности, был всесторонне изучен процесс образования перфораций венозной стенки. Перфорации начинали возникать при потоке энергии излучения в 30 Дж/см и более. В зоне перфорации возникала мгновенная усадка трубки (рис. 20). Это озна чает, что при перфорации вены, в паравазальных тканях возникают температуры, достигающие 125°С.

Рис. 20. Препарат БПВ, помещенный в штатив. В точке, где возникла перфорация вены,наблюдается локальная усадка трубки.
Такая температура должна вызывать повреждение окружающих вену структур.
Для более подробного изучения условий возникновения перфораций вены мы провели серию опытов на удалённых отрезках вен. Для этого вену, удалённую при операции, разрезали на отдельные участки длиной 2 см. Участки вены рассекались продольно и укладывались интимой наружу.
В первой серии опытов, производили прямое воздействие лазерного излучения на стенку вены, смоченную физиологическим раствором. При этом угол падения луча по отношению к интиме составлял от 45 до 90 градусов (рис.21). Поток энергии излучения составил 60 Дж на точку для лазера с длиной волны 1030 нм и столько же для лазера с длиной волны 1470 нм.
Рис. 21а. Воздействие излучения лазера с длиной волны 1030 нм на интиму вены, смоченную физиологическим раствором.
Рис. 21б. Воздействие излучения лазера с длиной волны 1470 нм на интиму вены, смоченную физиологическим раствором. Вена сморщилась.
Как видно, прямое воздействие лазера на лишенную крови вену было значительно более выражено для лазера с длиной волны 1470 нм. При этом происходило сморщивание вены, за счет коагулящии и сокращения молекул коллагена. Перфораций венозной стенки ни в одном случае выявлено не было.
Во второй серии опытов, производили прямое воздействие лазерного излучения на стенку вены, с нанесенной на интиму кровью (рис.22). Поток энергии составил 60 Дж на точку для лазера с длиной волны 1030 нм и столько же для лазера 1470 нм.
Повреждение вены, с нанесенной на интиму кровью, было выражено примерно одинаково для обоих лазеров. При этом для лазера с длиной волны 1030 нм примерно в 20% случаев возникали перфорации, тогда как при воздействии лазера с длиной волны 1470 нм перфораций венозной стенки ни в одном случае выявлено не было.
Рис. 22а. Воздействие излучения лазера длиной волны 1030 нм на интиму вены, смоченную кровью.
Рис. 22б. Воздействие излуче- ния лазера длиной волны 1470 нм на интиму вены, смоченную кровью.
В третьей серии опытов, производили прямое воздействие лазерного излучения на стенку вены, при этом кровь наносили на подложку, на которой лежала вена (рис.23). Поток энергии составил 60 Дж на точку для лазера длиной воны 1030 нм и столько же для лазера 1470 нм.
Воздействие лазерного излучения длиной волны 1030 нм в таких условиях приводило к мгновенному разогреву крови с газообразованием за стенкой вены. При этом в 100% случаев возникали перфорации стенки вены диаметром не менее 1 мм (рис. 23а). Для лазера с длиной волны 1470 нм перфораций венозной стенки ни в одном случае выявлено не было и разогрева крови с газообразованием не наблюдалось.
Из данного опыта следует важный вывод: для лазерного излучения длиной волны 1030 нм стенка вены практически прозрачна. Максимальное количество перфораций, как по числу, так и по размеру, возникает при попадании крови за пределы вены. У больных такая ситуация может возникать при создании тумесцентной анестезии, когда случайно иглой прокалывается стенка вены и кровь попадает в паравазальное пространство. При этом, как показал опыт с термоусадочной трубкой, за пределами вены создаётся высокая температура, способная повреждать окружающие ткани. Тот факт, что излучение длиной волны 1470 нм не вызывает перфораций вены, указывает на перспективность «водопоглощаемых» лазеров.
Сила теплового воздействия планируется с учётом общей доставленной энергии и является функцией интенсивности и длительности импульса лазерного излучения. Импульсный режим – один из способов спланировать термическое воздействие на венозную стену таким образом, чтобы тепло успевало рассеиваться в окружающих тканях в перерыве между импульсами. При появлении метода ЭВЛО априорно предполагалось, что это даёт потенциальную возможность в нужном месте — усилить термический эффект или на определённом расстоянии — уменьшить его, т.е. не дать перегреться окружающим тканям. Это явилось причиной того, что импульсный режим стал активно применяться на начальном этапе внедрения технологии ЭВЛО. Со временем опыт показал, что при таком режиме некоторые сегменты вены перегревались, другие же, наоборот, избегали воздействия лазера за счёт движения световода. Поэтому на данный момент предпочтительным считается непрерывный режим.
Поскольку реканализации вен возникают из-за недостаточного энергетического воздействия, мы решили проверить гипотезу, что для равномерного термического воздействия по всей длине вены важен не только правильно подобранный режим излучения, но и равномерность скорости тракции световода. Для этого мы сконструировали специальное устройство, обеспечивающее равномерную тракцию световода с одинаковой скоростью – 1 мм/сек. В 3-х мм от рабочей части световода мы разместили оптическое волокно прибора дистанционного измерения температуры. Во время процедуры ЭВЛО у 7 больных в режиме реального времени измерялась температура непосредственно в вене. При этом, при ручной тракции световода температурная кривая имела непредсказуемый вид, с разницей в значениях температуры в 30°С, от 70 до 100°С (рис.24).
Рис. 24. Кривая температуры в просвете вены при выполнении ЭВЛО с ручной тракцией световода. Кривая имеет непредсказуемый характер с большим размахом значений температуры.
При ультразвуковом контроле за прохождением ЭВЛО наблюдались частые перфорации вены. А при автоматической тракции световода температурная кривая имела ровный вид, с размахом колебаний температурных значений всего в 5°С в диапазоне около 85°С, т.е. в диапазоне оптимальной температуры для контракции коллагена (рис. 25). Послеоперационный период у таких больных протекал с менее выраженными признаками флебита.
Рис. 25. Кривая температуры в просвете вены при выполнении ЭВЛО с автоматической тракцией световода. Колебания температуры составляют не более 5 градусов.
Для создания анестезии и поглощения тепла лазерного излучения вокруг вены перед ЭВЛО создается «водная подушка». Раствор анестетика, введенный под контролем ультразвука в паравазальное пространство, «обжимает» вену вокруг световода. Поверхностные вены имеют относительно толстую стенку и поэтому меняют свой объем за счет увеличения внутреннего диаметра, сохраняя округлую форму в больших пределах. Исходя из этого предположения, интима венозной стенки должна иметь большую площадь, чем другие слои.
Многие авторы, применяющие ЭВЛО в своей практике, высказывают мнение, что диаметр коагулируемой вены не столь важен, так как при введении раствора анестетика она сжимается в несколько раз. Однако, опыт показывает, что качество облитерации напрямую зависит от диаметра ствола вены и чем больше этот диаметр, тем больше вероятность возникновения реканализации.
При создании вокруг вены давления за счет введения раствора анестетика, опорно-механический каркас венозной стенки, приспособленный к изменениям просвета, сокращается, а интима, не имея сократительных элементов должна образовывать складки и выросты. Эти складки должны увеличить толщину венозной стенки. Логично предположить, что вены с большим диаметром при тумесценции уменьшаются в сечении, но при этом площадь поверхности внутренней оболочки вены остаётся неизменной за счет образования складок.
Для проверки этой гипотезы нами в эксперименте на нефиксированных трупах произведено моделирование тумесцентной анестезии. Под ультразвуковым контролем проводилось введение раствора желатина по ходу БПВ в её фасциальный футляр на бедре. Таким образом, достигалась полная имитация тумесцентной анестезии. После застывания раствора желатина БПВ иссекали единым блоком с окружающими тканями и кожей. На поперечных срезах полученного препарата исследовали характер расположения интимы венозной стенки (рис. 26).
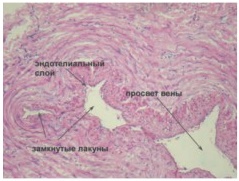
Рис. 26. Поперечный срез БПВ при моделировании тумесцентной анестезии. Увеличение в 160 раз. Окраска гематоксилин-эозин
Как показано на рис. 26, при создании тумесцентной анестезии внутренняя оболочка вены действительно образует складки, причем эти складки настолько выражены, что смыкаясь, образуют замкнутые лакуны, содержащие кровь. Интима практически прозрачна для лазера с «гемоглобинпоглощаемой» длиной волны. Поэтому разогрев гемоглобина происходит в этих лакунах независимо от его разогрева в просвете вены. Разогрев вены боль- шого калибра происходит крайне неравномерно, при этом часть энергии лазерного излучения теряется при прохождении че- рез линию складок. Для адекватной облитерации такая вена требует значительно большего потока лазерного излучения. При этом мгновенное выделение газа в замкнутой лакуне, ограниченной со всех сторон складками интимы, является своего рода «микровзрывом» и, может служить ещё одной из причин возникновения перфораций венозной стенки. Кроме того, высокие значения мощности лазерного излучения могут приводить к повреждениям структур, расположенных вблизи вены.
При воздействии повышенной температуры на ткани первые изменения возникают в белках и начинаются с коллагена.
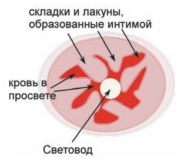
Рис. 26а. Схематичное изображение вены, «обжатой» раствором анестетика вокруг световода. Вид- ны складки и лакуны, заполненные кровью.
Эффект сокращения коллагеновых волокон при проведении процедуры ЭВЛО оказывает значительное воздействие на непосредственные и отсроченные результаты процедуры. Первые признаки денатурации и сокращения коллагена происходят при 40°С и становятся отчетливыми при 60-70°С (D.K. Dew, 1993). Термоиндуцированное сокращение кровеносных сосудов было обнаружено Gorish W., Boergen KP., (1982) при применении хирургического лазера в эксперименте на сосудах брыжейки кролика. Ультраструктурные исследования стенок сосудов продемонстрировали взаимосвязь сокращения сосуда и денатурации коллагеновых фибрилл. Однако тепло-индуцированная постоянная окклюзия данных сосудов может быть достигнута при температуре не менее 90°С в течение 18 сек.
Повреждение средней оболочки приводит к значительному сокращения диаметра вены и повреждению v. vasorum – как потенциального источника реканализации. Но гарантировать полное повреждение всей площади эндотелия и отсутствие дальнейшей его репарации может только длительное температурное воздействие, приводящее к сокращению коллагена. Процесс тромбообразования (тромбофлебит, флеботромбоз) в венах под действием различных факторов детально изучен многими российскими учеными (Савельев В.С., 2001; Швальб П.Г., Ухов Ю.И, 2009; и др.). Тромбопластическая активность венозной стенки больше, чем артерий, и для формирования стабильного тромба необходимо обнажение коллагена субэндотелиального слоя. Этот фактор лежит в основе метода ЭВЛО.
Индуцированное лазерным излучением повреждение эндотелия с обнажением субэндотелиального слоя приводит к развитию всех фаз воспаления и формированию тромба. Таким образом, после ЭВЛО одновременно протекают два взаимосвязанных механизма: тромбообразование и воспаление.
Появление воспалительных клеток в зоне ЭВЛО может быть обусловлено свободным протеканием крови через поврежденный участок в течение 2-3-х суток, т.к. окончательно тромб формируется к 3-м суткам (Гужков О.Н., 2008). Мигрирующие клетки обеспечивают фагоцитоз «обломков» клеток и белков.
При организации тромботических масс часто наблюдается врастание v. vasorum в толщу соединительной ткани тромба, что в дальнейшем приводит к образованию сосудистой сети, связывающей сосуды адвентиции и образующуюся соединительную ткань. После ЭВЛО такой процесс может приводить к формированию реканализаций за счет крови, притекающей по v. vasorum. Поэтому повреждение части v. vasorum, проходящей в медии, может исключить эту возможность.
После фагоцитоза остатков фибрина в тромботических массах образуются щели, которые являются основой для формирования сосудов синусоидного типа. Наползание эндотелия из сохранившихся участков в синусы может быть одним из путей реканализации.
Таким образом, полученные нами данные свидетельствуют, что процесс ЭВЛО более сложен, чем представлялось ранее, и состоит из трёх фаз. Его механизм универсален для всех видов лазерного излучения. При этом, «гемоглобинпоглощаемые» лазеры вызывают неоднородность термического повреждения интимы за счет её многочисленных складок и лакун, образуемых при создании тумесцентной анестезии. Кроме того, наличие крови в паравазальном пространстве в 100% случаев вызывает перфорацию вены. Излучение «водопоглощаемых» спектров лишено этих недостатков, и термическое поражение вены при его использовании достаточно однородное. Для адекватной равномерной облитерации вены недостаточно правильно установить режим лазерного излучения. Не менее важна равномерная тракция световода, которую можно обеспечить при использовании специальных автоматических устройств.
В настоящий момент в механизме реализации ЭВЛО и в процессе изменения венозной стенки после процедуры остается много неясного. До сих пор остается открытым вопрос о плотности потока лазерного излучения, необходимом для полной окклюзии вены определенного сечения, оптимальном диаметре вены, влиянии тумесцентной анестезии. Необходимы дальнейшие исследования процесса формирования термоиндуцированного тромба на разных сроках и его зависимости от параметров мощности, длины волны и др., а также выявление источников реканализации (v. vasorum, притоки подкожных вен и др.), что позволит минимизировать их возникновение.
Глава 5. Особенности эндовенозной лазерной облитерации при различных вариантах распространения патологических рефлюксов (Совместно с В.И.Ченом).
Современные подходы к хирургическому лечению ВРВНК предполагают устранение пораженных и сохранение функционально состоятельных венозных сегментов. Такой подход диктуется не только требованиями «разумной достаточности». Сохранённые работоспособные венозные сегменты могут понадобиться пациенту в дальнейшей жизни в качестве пластического материала, если возникнет необходимость выполнения реконструктивных вмешательств на артериальной системе.
При осмотре пациента для определения протяженности поражения поверхностных вен и планирования объёма оперативного вмешательства необходимо: во-первых, выявить источник рефлюкса крови (для БПВ – это чаще всего остиальный клапан), во-вторых, определить путь, по которому избыточная кровь возвращается в глубокую венозную систему. Как правило, из ствола БПВ рефлюкс «уходит» в дистально расположенный варикозно расширенный приток и далее дренируется в глубокую систему вен через перфорантную вену (вены). Таким образом, при подготовке к оперативному вмешательству на поверхностных венах по поводу ВРВНК следует вычленить три составных звена цепи патологической флебогемодинамики:
- источник (источники) рефлюкса
- маршрут (маршруты) распространения рефлюкса
- каналы возврата крови в систему глубоких вен
Для БПВ источником рефлюкса, как правило, служит недостаточный остиальный клапан. При состоятельном остиальном клапане источником рефлюкса могут служить проксимально расположены перфорантные вены или варикозно расширенные притоки, переполняющие ствол БПВ избыточным объёмом крови. Возникший обратный ток крови по стволу БПВ распространяется дистально до тех пор, пока не встретится с первым состоятельным клапаном.  Там он перенаправляется в ближайший приток с недостаточными клапанами. По маршруту распространения избыточного объёма крови (рефлюкса) формируется варикозная трансформация притоков. Из такого притока кровь через перфорантные вены вновь попадает в глубокую венозную сеть. Схема «кругооборота» крови при варикозной болезни представлена на рисунке 27.
Там он перенаправляется в ближайший приток с недостаточными клапанами. По маршруту распространения избыточного объёма крови (рефлюкса) формируется варикозная трансформация притоков. Из такого притока кровь через перфорантные вены вновь попадает в глубокую венозную сеть. Схема «кругооборота» крови при варикозной болезни представлена на рисунке 27.
При планировании хирургического лечения ВРВНК, необходимо представлять цельную схему патологической циркуляции избыточного объёма крови у данного больного. Поэтому в заключение ультразвукового ангиосканирования или осмотра хирурга такая состоящая из трёх узловых частей схема должна быть представлена обязательно.
Не вызывает сомнений необходимость хирургического устранения патологических источников рефлюкса. При этом перфорантные вены, дренирующие рефлюкс в глубокую систему вен, на начальных стадиях ВРВНК выполняют функцию разгрузки поверхностной венозной сети и не требуют устранения. Лишь по прошествие времени, когда в результате длительной перегрузки возникает клапанная недостаточность перфорантных вен, они подлежат ликвидации.
Рис. 27. Трёхзвенная схема патологического рефлюкса крови в бассейне БПВ.
5.1 Анатомические варианты и патофизиология сафено-феморального соустья и бассейна большой подкожной вены.
Типы распространения рефлюксов в стволе большой подкожной вены
При планировании объёма предстоящего вмешательства необходимо оценить протяженность рефлюкса. Для оценки его протяженности по БПВ целесообразно использовать разделение БПВ по сегментам (рис.28):
- проксимальный рефлюкс – в приустьевом отделе БПВ
- распространённый – до нижней трети бедра
- субтотальный – до средней трети голени
- тотальный – на всем протяжении конечности до лодыжки
- локальный – на ограниченном состоятельными клапанами участке БПВ
- изолированный рефлюкс в притоках – при отсутствии рефлюкса в стволе БПВ

проксимальный распространенный субтотальный
рефлюкс рефлюкс рефлюкс

тотальный локальный рефлюкс, изолированный
рефлюкс рефлюкс в притоках
Вариантная анатомия и пути распространения рефлюксов крови в зоне сафено-феморального соустья
Применение современных эндовазальных методов облитерации большой подкожной вены (БПВ) практически всегда подразумевает оставление её культи. Длинная культя БПВ часто, но не во всех случаях, становится причиной рецидива ВРВНК. К сожалению, в литературе до сих пор не появлялось попыток выявления таких вариантов, при которых культя БПВ не становится источником рецидива. Учитывая, что венозная система представляет собой сеть взаимосвязанных сосудов, теоретически любой сохранённый приток сафено-феморального соустья (СФС) может служить источником рецидива. Однако на практике, наибольший риск в возникновения рецидива несут имеющие сообщения с культей БПВ длинные венозные стволы, идущие параллельно с БПВ вдоль бедра, т.е. почти вертикально. Это, прежде всего, так называемые передние притоки. В литературе имеется много разночтений в их описании. Это обусловлено отсутствием в течение длительного времени унифицированной анатомической номенклатуры поверхностных вен нижних конечностей. Расхождения в описании этих притоков имеются даже в фундаментальных учебниках и руководствах. В.Н. Шевкуненко (1949) считал наличие одного или нескольких притоков, идущих кпереди от ствола БПВ, признаком задержанной редукции первичной венозной сети и называл такие притоки vv. saphenae accessoriae. Известный дагестанский флеболог Р.П.Аскерханов (1973), описывая вены передней части бедра, указывает, что они объединяются в вену, которую он назвал «передний кожный ствол бедра». В атласе под редакцией Р.Д. Синельникова (1996), передний приток не описан, а под vena saphena accessoria понимается медиальный приток, образующийся из подкожных вен медиальной поверхности бедра. Вышедшие в последнее время специализированные руководства, такие как «Флебология» под редакцией В.С.Савельева, «Основы клинической флебологии» под редакцией Ю.Л.Шевченко, называют один из этих притоков переднелатеральной веной или добавочной латеральной подкожной веной (vena saphena accessoria lateralis), а приток, идущий по медиальной поверхности бедра — добавочной медиальной подкожной веной (vena saphena accessoria medialis).
Для устранения подобных разночтений, как уже упоминалось, в 2001 г в Риме был создан Международный междисциплинарный консенсус по венозной анатомической номенклатуре. В соответствии с ним, эта вена, в зависимости от её расположения относительно фасциального футляра БПВ, может иметь три названия: задняя добавочная большая подкожная вена – любой венозный ствол на бедре и голени, идущий параллельно и кзади от БПВ; передняя добавочная большая подкожная вена — любой венозный сегмент на бедре и голени, идущий параллельно и кпереди от БПВ; поверхностная добавочная большая подкожная вена — любой венозный сегмент на бедре и голени идущий параллельно от БПВ и поверхностнее относительно её фасциального футляра. Кроме этой вены на бедре имеется передняя окружающая бедро вена. Она поднимается по передней поверхности бедра, обвивает его и дренируется в БПВ. Эта вена может иметь своим истоком латеральную венозную систему. Эти названия вен рекомендованы для использования во всех странах и приводятся в последних редакциях англоязычных руководств по флебологии. Для краткости будем называть все эти четыре сосуда передними притоками (ПП). Эти вены играют значимую роль в развитии как первичного ВРВНК, так и его рецидива. Одна из причин этого состоит в большой длине этих вен. Кроме этого, они не прикрыты фасциальным футляром. Большие шансы на безрецидивность после эндовазальных методов лечения ВРВНК обеспечит отсутствие сообщений культи БПВ с этими притоками.
Таким образом, на сегодняшний день объективно сложилась практическая потребность в разработке классификации СФС. Одной из сложностей в создании такой классификации является чрезвычайная вариабельность взаимоотношений притоков друг с другом и с магистральным стволом. В руководстве под редакцией J.J.Bergan, являющимся учебником для большинства западных флебологов, приводится 4 типа СФС. К сожалению, в тексте не указано, по какому принципу эти варианты были выделены и какое практическое значение они имеют. В известном атласе венозной системы Ph. Blanchemaison (1996) выделены отдельные типы эктазий и варианты раздвоений терминального отдела БПВ. Автор называет их 1-й, 2-й и 3-й тип. Такие названия, на наш взгляд, не несут конкретной информации. В атласе C. Gillot (1998) представлено описание множества вариантов расположения поверхностных вен, однако стремления классифицировать варианты СФС в нём не усматривается. Серьёзная попытка классифицировать типы СФС была предпринята K. Janowski и M Topol. (2004). Авторами проведена большая работа, в результате которой все встретившиеся им варианты СФС были разделены на 5 типов, каждый из которых имеет подтипы. К сожалению, классификация получилась громоздкой и сложной в практическом применении. Кроме того, она систематизирует только встретившиеся авторам варианты, а классификация должна охватывать все возможные варианты. Ни одна из классификаций СФС не получила широкого распространения в клинической практике. Между тем, наличие единой логически стройной классификации является важнейшим показателем научности соответствующей области знаний.
Анализ и обобщение результатов проведенных нами более чем 10 тысяч ультразвуковых исследований и интраоперационных наблюдений, а также данных специальной литературы, позволили нам предпринять попытку систематизировать варианты строения СФС.
В основу деления мы положили шесть наиболее существенных для хирургического лечения анатомических признаков: конфигурация терминального отдела БПВ; форма эктазии терминального отдела БПВ; тип ближайшего к общей бедренной вене (ОБВ) притока; наличие гемодинамически значимого переднего притока; наличие дополнительных соединений глубоких и поверхностных вен в зоне СФС; взаиморасположение глубоких сосудов в зоне бедренного треугольника.
За основу первых двух разделов была взята классификация, приведенная в атласе поверхностной венозной системы Ph. Blanchemaison (1996).
АНАТОМИЧЕСКАЯ КЛАССИФИКАЦИЯ ВАРИАНТОВ СТРОЕНИЯ СФС:
1. По конфигурации терминального отдела БПВ
I – образная конфигурация
h – образная конфигурация
O – образная конфигурация
F – образная конфигурация
Плексиформная конфигурация
2. По форме эктазии терминального отдела БПВ
2.1. Без эктазии терминального отдела БПВ
2.2. Эктазия в области устьевого отверстия ОБВ
2.3. Эктазия сегмента БПВ под остиальным клапаном
2.4. Эктазия сегмента БПВ под преостиальным клапаном
3. По ближайшему к ОБВ притоку
3.1. Ближайший к ОБП приток – поверхностная надчревная вена
3.1.1. Поверхностная надчревная вена не сообщается с прочими притоками БПВ
3.1.2. Поверхностная надчревная вена сообщается с прочими притоками БПВ
3.2. Ближайший к ОБВ приток не является поверхностной надчрев- ной веной БПВ
4. По локализации устья переднего притока БПВ
4.1. Впадение переднего притока в латеральную стенку БПВ
4.2. Впадение переднего притока в переднюю стенку БПВ
4.3. Впадение переднего притока в заднюю стенку БПВ
4.4. Образование единого ствола из переднего притока и других притоков БПВ
4.5. Без устья переднего притока в БПВ
5. По наличию дополнительных соединений глубоких и поверх- ностных вен в зоне бедренного треугольника
5.1. С впадением проксимальных притоков БПВ в ОБВ
5.1.1. Впадение притока в ОБВ выше СФС 91
5.1.2. Впадение притока в ОБВ ниже СФС
5.2. С соединением проксимальных притоков БПВ и прочих глубо- ких вен
5.3. С впадением глубоких вен в терминальный отдел БПВ
5.3.1. С впадением постоянных притоков БВ в терминальный отдел БПВ
5.3.2. С впадением прочих глубоких вен в дугу БПВ 5.4. Без дополнительных соединений глубоких и поверхностных вен в зоне бедренного треугольника.
6. Взаиморасположение глубоких сосудов в зоне бедренного треу- гольника
6.1. Типичное расположение глубоких сосудов
6.2. Атипичное расположение глубоких сосудов
6.2.1. Расположение ОБА кпереди от ОБВ с образованием С – образного СФС
6.2.2. Расположение глубоких вен в фасциальном пространстве БПВ
Классификация по конфигурации терминального отдела БПВ
Конфигурация терминального отдела БПВ имеет исключительно важное значение при выборе метода хирургического лечения варикозной болезни. Наиболее распространён вариант строения с прямолинейным ходом приустьевой части БПВ. Наряду с этим существуют варианты с изменённой конфигурацией и раздвоением ствола. Выявление этих вариантов во время предоперационного дуплексного ангиосканирования позволяет хирургу более тщательно спланировать предстоящее вмешательство.
Конфигурация терминального отдела БПВ имеет исключительно важное значение при выборе метода хирургического лечения варикозной болезни. Наиболее распространён вариант строения с прямолинейным ходом приустьевой части БПВ. Наряду с этим существуют варианты с изменённой конфигурацией и раздвоением ствола. Выявление этих вариантов во время предоперационного дуплексного ангиосканирования позволяет хирургу более тщательно спланировать предстоящее вмешательство.
1.1. I – образная конфигурация терминального отдела БПВ
 Здесь и далее:
Здесь и далее:
ОБА – общая бедренная артерия
ОБВ – общая бедренная вена
ПНВ – поверхностная надчревная вена
НСВ – наружная срамная вена ПВОПК – поверхностная вена, окружающая подвздошную кость
Рис. 29. I-тип терминального отдела БПВ.
Самый распространённый вариант строения. Эндовазальные методы обработки СФС более всего подходят для этого «классического» варианта строения. Встречается примерно у 95% людей.
1.2. h – образная конфигурация терминального отдела БПВ

Рис. 30. h – образная конфигурация терминального отдела БПВ.
При этой конфигурации в терминальный отдел БПВ впадает передний приток, по форме и диаметру примерно соответствующий БПВ, поэтому во время операции его можно ошибочно принять за БПВ. При этом может быть оставлен не удалённым один из стволов с притоками. При использовании эндовазальных методов облитерации необходимо облитерировать оба этих ствола . Этот вариант встречается приметно в 4% случаев.
1.3. O – образная конфигурация терминального отдела БПВ

Рис. 31. O – образная конфигурации терминального отдела БПВ.
В данной ситуации терминальный отдел БПВ внезапно раздваивается и, образовав два ствола, у входа в БВ вновь соединяется в единый ствол. В этом случае во время операции можно ошибочно принять за БПВ один из его стволов, а место их слияния – за БВ. При этом может быть оставлен один из стволов с притоками. При использовании эндовазальных методов облитерации необходимо облитерировать оба этих ствола . Этот вариант встречается менее чем в 1% случаев.
 1.4. F – образная конфигурация терминального отдела БПВ
1.4. F – образная конфигурация терминального отдела БПВ
В данной ситуации формируются два отдельных СФС. К ним подходят венозные стволы, образованные из БПВ. Во время операции одно из соустий может остаться незамеченным и неперевязанным. От использовании эндовазальных методов облитерации в данной ситуации следует воздержаться, так как одновременно облитерировать оба ствола технически сложно. Этот вариант встреча-
Рис. 32. F — образная конфигу- ется менее чем в 1% случаев. рации терминального отдела БПВ.
1.5. Плексиформная конфигурация терминального отдела БПВ

Рис. 33. Плексиформная конфигурация терминального отдела БПВ.
Данный вариант строения терминального отдела БПВ наиболее сложен для хирургического лечения. Во время операции существует риск повредить вены при их выделении, также некоторые притоки могут остаться незамеченными и неперевязанными. От использовании эндовазальных методов облитерации в этой ситуации следует воздержаться. Этот вариант встречается менее чем в 1% случаев.
Классификация по форме эктазии терминального отдела БПВ
Наличие эктазии СФС для хирургов, владеющих всеми современными методами лечения варикозного расширения вен, является основным критерием при выборе вида вмешательства. Между тем, кроме собственно диаметра, не менее важно оценить и тип расширения терминального отдела БПВ. Эктазия БПВ чаще всего возникает под остиальным клапанном. Возможен вариант, когда возникает недостаточность преостиального клапана с типичной подклапанной эктазией. И наконец, в ряде случаев наблюдается вариант эктазии непосредственно устьевого отверстия ОБВ.
2.1. Без эктазии терминального отдела БПВ

Рис. 34. Отсутствие эктазии БПВ.
На ультразвуковой сканограмме представлен вариант анатомической нормы терминального отдела БПВ. Отчетливо виден остиальный клапан. Ствол БПВ имеет ровный ход, без видимых расширений.
2.2. Эктазия в области устьевого отверстия БПВ

Рис. 35. Эктазия области устьевого отверстия БПВ.
Вариант, при котором устьевое отверстие ОБВ настолько широко, что при попытке выполнить перевязку устья БПВ, можно надорвать стенку ОБВ. Для эндовазальных методов облитерации этот тип эктазии не подходит. Он встречается менее чем в 1% всех наблюдений.
2.3. Эктазия сегмента БПВ под остиальным клапаном

Рис. 36. Эктазия области под остиальным клапаном БПВ.
Расширение находится под створками остиального клапана. Встречается в 95% случаев эктазий терминального отдела БПВ.
2.4. Эктазия сегмента БПВ под преостиальным клапаном

Рис. 37. Эктазия сегмента БПВ под преостиальным клапаном.
Вариант эктазии, при котором имеется расширение ниже створок преостиального клапана БПВ. Как правило, при таком варианте эктазии рефлюкс через остиальный клапан отсутствует. Это самый благоприятный вариант для современных способов эндовазальной облитерации.
Составляет примерно 5% эктазий терминального отдела БПВ.
Классификация типов СФС по ближайшему к ОБВ притоку
Эта классификация создавалась специально для хирургов, использующих эндовазальные методы облитерации БПВ. На сегодняшний день не существует ни одного эндовазального способа облитерации БПВ, при котором СФС можно было бы обработать так же тщательно, как и при классической кроссэктомии. Именно этот аргумент является самым весомым против широкого применения внутрисосудистых вмешательств при ВРВНК. Выделение «безопасных», с точки зрения риска развития рецидива, типов СФС поможет принять правильное решение относительно выбора вида операции у конкретного пациента.
3.1. Ближайший к ОБВ приток – поверхностная надчревная вена

Рис. 38. Ближайший к ОБВ приток – поверхностная надчревная вена.
Впадение поверхностной надчревной вены в БПВ встречается в двух вариантах:
3.1.1. Поверхностная надчревная вена не сообщается с прочими притоками БПВ
3.1.2. Поверхностная надчревная вена сообщается с прочими притоками БПВ
Первый вариант является оптимальным для эндовазальных методов облитерации, так как в притоке с кровотоком по вектору силы тяжести не может возникнуть варикозной трансформации. Встретился у 50% обследованных пациентов.
 При втором варианте строения, один или несколько проксимальных притоков БПВ впадают не в неё, а в поверхностную надчревную вену (рис.39). При данном варианте строения должен быть применён такой хирургический способ обработки СФС, при котором не будет оставлена культя вообще. Если этого не сделать, рефлюкс через сохранённый несостоятельный остиальный клапан БПВ, пройдя небольшой вертикальный участок поверхностной надчревной вены, сможет распространиться далее вниз через устья других притоков. Это создаст высокую вероятность развития рецидива. Данный вариант взаимоотношения при- токов встретился у половины обследован- ных нами пациентов.
При втором варианте строения, один или несколько проксимальных притоков БПВ впадают не в неё, а в поверхностную надчревную вену (рис.39). При данном варианте строения должен быть применён такой хирургический способ обработки СФС, при котором не будет оставлена культя вообще. Если этого не сделать, рефлюкс через сохранённый несостоятельный остиальный клапан БПВ, пройдя небольшой вертикальный участок поверхностной надчревной вены, сможет распространиться далее вниз через устья других притоков. Это создаст высокую вероятность развития рецидива. Данный вариант взаимоотношения при- токов встретился у половины обследован- ных нами пациентов.
Рис. 39. Ближайший к ОБВ при- ток – поверхностная надчревная вена, которая сообщается с прочи- ми притоками БПВ.
3.2. Ближайший к ОБВ приток не является поверхностной надчревной веной
Этот вариант мало подходит для эдовазальных методов облитерации,
т.к. оставленная культя с идущим снизу притоком с высокой долей вероятности может привести к возникновению рецидива.
 Классификация по локализации устья переднего притока БПВ
Классификация по локализации устья переднего притока БПВ
Поскольку передний приток имеет существенное значение в развитии рецидива варикозного расширения вен, для правильной хирургической обработки зоны СФС следует установить локализацию его устья. Кроме этого, необходимо знать расположение и ход ствола переднего притока, так как он нередко бывает по диметру сопоставим с БПВ, с которой его легко перепутать.
Рис. 40. Ближайший к ОБВ приток не является поверхностной надчревной веной.
4.1. Впадение переднего притока в латеральную стенку БПВ

Рис. 41. Впадение переднего притока в латеральную стенку БПВ.
Данный вариант представляет собой «классическое» впадение переднего притока отдельным стволом. У пациентов с таким строением клинически может определяться форма так называемого латерального варикоза. Встречается примерно в 1/3 случаев.
4.2. Впадение переднего притока в переднюю стенку БПВ

Рис. 42. Впадение переднего притока в переднюю стенку БПВ.
Ситуация, при которой расширенный передний приток симулирует собой БПВ, за которую его можно принять во время операции. Данный вариант описан в атласе Ph. Blanchemaison (1996) как Н-тип. При этом варианте строения хирург, производящий кроссэктомию и стриппиг, может удалить передний приток, ошибочно приняв его за БПВ. Сам ствол БПВ при этом не будет удалён, что может опять-таки привести к развитию рецидива. Этот вариант строения имеет место примерно в 1 % случаев.
 4.3. Впадение переднего притока в заднюю стенку БПВ
4.3. Впадение переднего притока в заднюю стенку БПВ
Рис. 43. Впадение переднего притока в заднюю стенку БПВ.
Такая анатомическая локализация устья переднего притока не представляет сложностей как для обычной кроссэктомии, так и для эндовазальных методов облитерации. Такой вариант строения встречается менее чем в 1 % случаев.
4.4. Образование единого ствола из переднего притока и других притоков БПВ

Рис. 44. Образование единого ствола из переднего притока и других притоков БПВ.
Данный вариант встречается у 2/3 людей. От того, с каким сосудом передний приток образует единый ствол, во многом зависит вероятность развития рецидива в послеоперационном периоде. Чем ближе это происходит к бедренной вене, тем больше вероятность не перевязать его при кроссэктомии или не облитерировать его устье при эндовазальных методах.
4.5. Без переднего притока БПВ
Кроме вариантов, когда ПП вливается в БПВ дистальнее СФС, сюда входят случаи, изображённые на рисунках 32, 33, когда передний приток впадает не в терминальный отдел БПВ, а непосредственно в систему глубоких вен. Перед хирургической обработкой СФС в этой ситуации следует так спланировать вмешательство, чтобы устранить патологический рефлюкс из глубоких вен в передний приток.
Классификация СФС по наличию дополнительных соединений глубоких и поверхностных вен в зоне бедренного треугольника
5.1. С впадением проксимальных притоков БПВ в ОБВ
Впадение проксимальных притоков непосредственно в ОБВ может встречаться в двух вариантах:
5.1.1. Впадение притока в ОБВ ниже СФС
5.1.2. Впадение притока в ОБВ выше СФС
Примерно 90% случаев впадения притоков пучка Дельбе в ОБВ приходится на сегмент ОБВ от 1 до 3 см ниже СФС.
 Этот анатомический вариант некоторыми авторами назван «двухстволка» (Ph. Blanchemaison, 1996). Авторы рассматривают этот вариант в числе прочих видов удвоения терминального отдела БПВ. Однако фактически здесь имеет место не удвоение БПВ, а наличие двух разных сосудов. Поэтому, с нашей точки зрения, рассматривать вариант «двухстволки» в числе раздвоений терминального отдела БПВ неправомочно. Вполне закономерно будет включить этот вариант в раздел классификации по наличию дополнительных соединений глубоких и поверхностных вен.
Этот анатомический вариант некоторыми авторами назван «двухстволка» (Ph. Blanchemaison, 1996). Авторы рассматривают этот вариант в числе прочих видов удвоения терминального отдела БПВ. Однако фактически здесь имеет место не удвоение БПВ, а наличие двух разных сосудов. Поэтому, с нашей точки зрения, рассматривать вариант «двухстволки» в числе раздвоений терминального отдела БПВ неправомочно. Вполне закономерно будет включить этот вариант в раздел классификации по наличию дополнительных соединений глубоких и поверхностных вен.
Рис. 45. Впадение притока в ОБВ ниже СФС.

Еще один вариант, когда может встречаться «двухстволка». Непосредственно в бедренную вену могут впадать любые притоки БПВ. Описаны варианты впадения поверхностной надчревной вены, поверхностной окружающей подвздошную кость вены, а также наружной срамной вены [15,16]. Они могут создавать собственные соустья с ОБВ или образовывать отдельный ствол, открывающийся в просвет ОБВ. Возможен вариант, когда передний приток огибает с латеральной стороны бедренную артерию и впадает в ОБВ или даже в глубокую вену бедра (ГВБ) кзади от ОБА.
Рис. 46. Впадение притока в ОБВ выше СФС.
5.2. С соединением проксимальных притоков БПВ и прочих глубоких вен
 Рис. 47. Впадение наружной срамной вены в приток ОБВ – медиальную огибающую бедренную кость вену (МОБКВ).
Рис. 47. Впадение наружной срамной вены в приток ОБВ – медиальную огибающую бедренную кость вену (МОБКВ).
Дополнительные соединения поверхностных и глубоких вен в зоне бедренного треугольника могут встречаться достаточно часто. М. Lefebvre-Vilardebo (1991) приводит результаты собственных исследований, согласно которым «изолированное» СФС встречается только у 57% людей. У остальных – имеются различные варианты соединений поверхностных и глубоких вен в зоне бедренного треугольника, которые не обнаруживаются и не лигируются во время кроссэктомии. Эти вены могут быть источником послеоперационного рецидива ВРВНК.
5.3. С впадением глубоких вен в терминальный отдел БПВ
5.3.1. С впадением постоянных притоков ОБВ в терминальный отдел БПВ

Рис. 48. Впадение постоянного притока БВ — МОБКВ в терминальный отдел БПВ.
Вариант впадения МОБКВ, постоянного притока ОБВ из числа глубоких вен, в дугу БПВ. Устье МОБКВ при этом расположено поверхностнее глубокой фасции. Такая картина выявляется у 1% больных.
5.3.2. С впадением прочих глубоких вен в дугу БПВ

Рис. 49. Впадение вены-спутницы БВ в терминальный отдел БПВ.
Бедренную вену иногда сопровождают вены-спутницы. Данный вариант весьма редкий, его описания в литературе – единичны (Илюхин Е.А., 2009). На ультразвуковой сканограмме (рис.36) отчетливо видно, что вена-спутница бедренной вены находится в одном фасциальном футляре с ОБВ.
5.4. Без дополнительных соединений глубоких и поверхностных вен в зоне бедренного треугольника.
Соответствует «классическому» варианту, описанному в большинстве анатомических атласов.
6. Взаиморасположение глубоких сосудов в зоне бедренного тре- угольника
6.1 Типичное расположение глубоких сосудов
6.2 Атипичное расположение глубоких сосудов

Рис. 50. С-образное СФС.
Расположение ОБА кпереди от ОБВ с образованием С — об-разного СФС
При этом варианте БПВ лежит на передней стенке ОБА, в терминальном отделе С-образно изгибается и образует соустье с ОБВ. Описан вариант, при котором БПВ, С-образно изгибаясь, впадает в ОБВ с латеральной стороны от бедренной артерии (Чуриков Д.А., 2008). Относится к редким анатомическим вариантам. Во время выполнения кроссэктомии существует риск повреждения бедренной артерии.
Расположение глубоких вен в фасциальном пространстве БПВ

Рис. 51. Расположение поверхностной бедренной вены (ПБВ) в фасциальном пространстве БПВ.
За всё время исследований этот вариант встретился нам только однажды. БПВ лежит в одном фасциальном футляре с поверхностной бедренной веной и впадает в неё под паховой связкой. Поверхностная бедренная вена соединяется с глубокой веной бедра выше СФС в lacuna vasorum. На 2 мм ниже СФС в ПБВ впадает передний приток.
Топографическая анатомия и пути распространения рефлюксов крови при разных вариантах расположения БПВ относительно поверхностной фасции на бедре
На бедре ствол БПВ находится в собственном фасциальном футляре. Для его образования поверхностный лист широкой фасции бедра расщепляется на два листка. В верхней трети бедра, в области пахового треугольника, он срастается с внутренней частью паховой связки. Передняя стенка фасциального канала в англоязычной литературе называется «saphenous fascia». Она представляет собой фасциальную пленку, покрывающую ствол БПВ спереди. Задняя стенка этого канала намного толще и прочнее передней. Фасциальный футляр особенно хорошо выражен в верхней и средней части бедра и в средней и нижней части голени. В области коленного сустава фасция зачастую выражена слабее. Содержимое канала, кроме ствола БПВ, составляют нерв и жировая ткань. Последняя разделена на ячейки соединительнотканными перегородками, отходящими от внутренней поверхности стенок фасциального канала. Ячейки из жировой ткани вместе с фасцией создают вокруг ствола БПВ упруго-эластическую подушку, благодаря которой вена не претерпевает выраженной варикозной трансформации, в отличие от свободно лежащих вне фасциального футляра притоков. На рисунке 52 представлен фасциальный канал БПВ на бедре, вскрытый в одной из своих частей. На фотографии отчетливо видна жировая ткань – основное, после вены, содержимое канала. Ствол БПВ имеет собственную связку, которая прикреплена с одной стороны к стенке вены, и к фасциальным стенкам канала с другой. На рисунке 53 показан канал БПВ в верхней трети бедра при поперечном ультразвуковом сканировании. Отчетливо видны стенки канала и связка БПВ.
Как уже указывалось, на бедре ствол БПВ и его крупные притоки могут располагаться по отношению к фасциальному футляру в трёх вариантах:
i-тип, при котором ствол БПВ целиком лежит субфасциально от
сафено-феморального соустья до коленного сустава (рис.54). h-тип, при котором ствол БПВ сопровождает крупный приток, расположенный надфасциально. В определенном месте он прободает фасцию и впадает в БПВ. Дистальнее этого места ствол БПВ имеет значительно меньший диаметр, чем его приток (рис.55). s-тип, крайняя степень h-типа, при этом ствол БПВ дистальнее ме-
ста впадения притока аплазирован. При этом создается впечатление, что ствол БПВ в какой-то момент круто меняет направление, прободая фасцию (рис.56, 57).
 Рис. 52. Фотография фасциального канала БПВ на бедре у трупа.
Рис. 52. Фотография фасциального канала БПВ на бедре у трупа.

Рис. 53. Фасциальный канал БПВ при ультра- звуковом сканировании в поперечном срезе.

Рис. 54. i-тип, при котором ствол БПВ целиком лежит субфасциально от сафено-феморального соустья до коленного сустава.

Рис. 55. h-тип, при котором ствол БПВ сопровождает крупный приток, расположенный надфасциально. Поперечная ультрасканограмма на уровне впадения притока в БПВ.

Рис. 56. s-тип, при котором ствол БПВ «возникает» из крупного притока, расположенного надфасциально.

Рис. 57. S-тип, ультразвуковая сканограмма поперечного и продольного сканирования участка с аплазией БПВ.
Имеющийся фасциальный канал многими авторами рассматривается как защитный наружный «чехол», предохраняющий ствол БПВ от чрезмерного растяжения. При этом упруго-эластические свойства окружающей вену жировой клетчатки, заключенной в соединительнотканный чехол, значительно возрастают.
Есть мнение, что s- и h- типы расположения БПВ являются редукционными, т.е. лежащий надфасциально венозный ствол является притоком БПВ, а сама БПВ в фасциальном канале редуцирована (h-тип) или аплазирована (s-тип).
Сила давления крови на стенки БПВ уравновешивается противодействием силы упругости стенки вены и «подушки» фасциального канала, которые механически представляют собой единое целое. Дистальнее места перфорации поверхностной фасции притоком вены давление на стенку вены (притока) возрастает, т.к. возрастает масса столба крови от правого предсердия. В то же время упруго-эластическое сопротивление стенки вены уменьшаются ровно на величину упруго-эластических свойств отсутствующего в этом месте фасциального футляра. При потере веной своих упруго-эластических свойств в силу генетических, возрастных и прочих причин её стенка деформируется. Вена растягивается до того момента, пока сила напряжения ее стенки не уравновесит силу, вызвавшую деформацию. В этом случае вену заполняет избыточный объем крови. Появление избыточного объема в расширенном сосуде приводит к падению скорости кровотока в нем. Замедление кровотока, в свою очередь, вызывает реакцию эндотелия, запускает роллинг лейкоцитов с прочими феноменами, приводящими к варикозной трансформации венозной стенки. Такое представление частично подтверждают данные проведенного нами исследования распространённости вариантов расположения БПВ на бедре. Согласно его результатам, у половины больных с рефлюксом по БПВ и варикозной трансформацией подкожных вен, имелись редукционные анатомические типы. В это же время у здоровых лиц, не имеющих рефлюкса по БПВ, в75% случаев имелся i-тип расположения вены относительно фасции.
Закономерно, что различные варианты расположения БПВ предрасполагают к неодинаковым путям распространения рефлюксов крови.
Пути распространения рефлюкса и тактика ЭВЛО при i-типе расположения
БПВ
По нашим данным, в общей популяции i-тип расположения БПВ встречается примерно в у 66% людей. При этом типе рефлюкс от остиального клапана, как правило, распространяется до коленного сустава и далее, до границы верхней и средней трети голени (рис.58). В этом месте избыточный объём крови, «пришедший» в вену с рефлюксом, «уходит» в поверхностно расположенный приток (или притоки) и далее дренируется в глубокую венозную систему через перфорантные вены. Учитывая возможность прорастания эндотелия из устьев этих притоков в ствол облитерированный БПВ с развитием реканализации в отдалённый период, мы рекомендуем увеличивать поток энергии лазера в зоне устьев притоков. Для этого следует заранее размечать на коже места впадения притоков в БПВ и, ориентируясь на пилотный луч в зоне разметки, в 1,5 раза, в отличии от прочей части ствола БПВ, увеличить плотность потока энергии.

Рис. 58. Путь распространения рефлюкса крови при i-типе расположения БПВ.
Существует ещё один вариант возникновения и распространения рефлюксов крови, при котором остиальный клапан остаётся интактным, а клапанная недостаточность возникает дистальнее, иногда от середины бедра распространяясь до коленного сустава и ниже (рис.59). Это – самый благоприятный вариант для выполнения ЭВЛО. Учитывая отсутствие приустьевой эктазии БПВ, риск «недокоагулировать» проксимальный отдел БПВ с последующим развитием реканализации — минимален. Если при таком варианте выполнить ЭВЛО только в сегменте вены с несостоятельным клапанным аппаратом, в послеоперационном периоде может развиться восходящий тромбофлебит проксимальной части БПВ. Поэтому, во всех случаях такого анатомического варианта, ЭВЛО обязательно производится по всей длине вены от нижней границы рефлюкса до остиального клапана.

Рис. 59. Вариант возникновения и распространения рефлюкса крови при i-типе расположения БПВ.
Пути распространения рефлюкса и тактика ЭВЛО при h-типе расположения БПВ
Несколько иные варианты распространения патологического рефлюкса имеются при редукционных типах расположения БПВ на бедре. Достаточно часто наблюдается вариант h-типа, при котором ствол БПВ от остиального клапана до места впадения магистрального надфасциального притока имеет состоятельный клапанный аппарат. Патологический рефлюкс, в данной ситуации, возникает в сегменте соединения вены с БПВ (рис.60) и распространяется на бедре и голени, также дренируясь в глубокую систему через перфорантные вены. Причём, в данной ситуации, часто эти дренирующие рефлюкс перфоранты располагаются по латеральной поверхности голени.

Рис. 60. Вариант распространения патологического рефлюкса при h-типе расположения БПВ. Рефлюкс начинается от места впадения притока в редуцированный ствол БПВ.
В данной ситуации имеют право на существование несколько хирургических подходов. Во-первых, можно тем или иным способом убрать расширенный приток, сохранив тем самым весь ствол БПВ, имеющий к тому же нормально функционирующий клапанный аппарат. Такой вариант операции наиболее отвечает современным требованиям сохранения нормально функционирующих сегментов вены и минимальной инвазивности. Однако следует помнить, что резкое уменьшение объемного кровотока по сегменту БПВ от устья удалённого притока до остиального клапана неминуемо вызовет реакцию эндотелия этого сегмента и с высокой долей вероятности приведёт к развитию восходящего тромбофлебита. Исходя из этого, планируя предстоящее вмешательство, следует оценить, насколько в результате упадёт объёмный кровоток. В случае если такое падение будет значительным, необходимо облитерировать весь ствол БПВ до остиального клапана. При этом пункцию БПВ и введение световода следует проводить дистальнее впадения расширенного притока с тем, чтобы «закрыть» его устье. Сам приток можно облитерировать при помощи ЭВЛО, если он имеет ровный ход, и его отделяет от кожи прослойка жировой клетчатки. В противном случае имеются два альтернативных варианта: минифлебэктомия или эхоконтролируемая склеротерапия. В своей практике мы чаще выполняем минифлебэктомию. Преимущество этого метода в данной ситуации состоит в его радикальности и отсутствии специфических для склеротерапии последствий в виде образования коагул и гиперпигментации.
Второй, наиболее часто встречающийся вариант распространения рефлюкса при h-типе, состоит в несостоятельности клапанного аппарата БПВ от остиального клапана. Далее рефлюкс «уходит» в расширенный надфасциально расположенный приток (рис.61) и распространяется на бедре и голени, также дренируясь в глубокую систему через перфорантные вены голени. При таком варианте дренирующие рефлюкс перфоранты также могут располагаться на латеральной поверхности голени. Редуцированный участок БПВ на бедре при этом всегда имеет малый диаметр и состоятельный клапанный аппарат.

Рис. 61. Вариант распространения патологического рефлюкса при h-типе расположения БПВ. Рефлюкс начинается от остиального клапана и «уходит» в расширенный надфасциально расположенный приток.
Хирургическая тактика в этой ситуации должна включать обязательную облитерацию сегмента БПВ до остиального клапана. Пункцию БПВ и введение световода нужно проводить дистальнее впадения расширенного притока с тем, чтобы «закрыть» его устье. В случае, если это не удается, мы мобилизуем надфасциально расположенный приток и через него проводим ангиографический катетер размером 5F. Катетер в этой ситуации очень удобен, так как позволяет пройти резкий изгиб вены в этом месте. Угол такого изгиба может составлять до 900 и пройти его одним световодом технически очень сложно.
Пути распространения рефлюкса и тактика ЭВЛО при s-типе расположения БПВ
Этот вариант очень близок к описанному h-типу. S-тип – это крайняя степень редукции (аплазии) ствола БПВ дистальнее места впадения притока. Вариантов распространения рефлюкса при этом тоже два, они представлены на рисунках 62 и 63.

Рис. 62. Вариант распространения патологического рефлюкса при s-типе расположения БПВ. Рефлюкс начинается от места «входа» притока в фасциальный канал БПВ.
 Хирургическая тактика в этих двух случаях аналогична тактике при h-типе с той лишь разницей, что дистальнее устья расширенного притока ввести световод возможности не будет. Световод при этом варианте вводится непосредственно в БПВ выше впадения притока или через сам приток при помощи ангиографического катетера.
Хирургическая тактика в этих двух случаях аналогична тактике при h-типе с той лишь разницей, что дистальнее устья расширенного притока ввести световод возможности не будет. Световод при этом варианте вводится непосредственно в БПВ выше впадения притока или через сам приток при помощи ангиографического катетера.
Правильная хирургическая тактика, опирающаяся на знание путей распространения патологических рефлюксов на бедре, поможет избежать возникновения рецидивов не только в этой, но и в других анатомических областях.
Рис. 63. Вариант распространения патологического рефлюкса при s-типе расположения БПВ. Рефлюкс начинается от остиального клапана БПВ.
ПУТИ ПАТОЛОГИЧЕСКОГО ТОКА КРОВИ ПРИ ПРОКСИМАЛЬНОМ РЕФЛЮКСЕ В СТВОЛЕ БПВ
Проксимальный рефлюкс крови по БПВ, по нашим данным, встречается примерно у 25% больных с начальными формами ВРВНК. Этот тип поражения ствола БПВ интересен как в плане лечения, так и в отношении прогноза развития заболевания. Прежде всего следует выделить два его варианта: первый вариант является начальной стадией варикозного поражения вен нижних конечностей. При этом варианте рефлюкс распространяется от остиального клапана по стволу БПВ до верхней трети бедра. Иногда притоки, в которые «уходит» избыточная кровь определить сложно, ещё большие сложности вызывает попытка выявить канал (каналы), по которым кровь возвращается в глубокие вены.
Проксимальный рефлюкс по БПВ наиболее часто дренируется в переднюю добавочную БПВ. При этом ПДБПВ может впадать в основной ствол БПВ на разных уровнях – от остиального клапана до нижней трети бедра (рис.64-66).

Рис. 64. Проксимальный рефлюкс в БПВ, дренирующийся в ПДБПВ.
Рис. 65. Проксимальный рефлюкс в БПВ, дренирующийся в ПДБПВ и ЗОБВ.
 Рис. 66. Проксимальный рефлюкс в БПВ, дренирующийся в средней трети бедра в ПДБПВ.
Рис. 66. Проксимальный рефлюкс в БПВ, дренирующийся в средней трети бедра в ПДБПВ.
 Рис. 67. Проксимальный рефлюкс в БПВ, кольцеобразно замыкающийся в дистальной части БПВ на бедре и далее дренирующийся в перфорантные вены голени
Рис. 67. Проксимальный рефлюкс в БПВ, кольцеобразно замыкающийся в дистальной части БПВ на бедре и далее дренирующийся в перфорантные вены голени
В глубокую систему вен избыточный объём крови дренируется через:
- перфорантные вены задней поверхности бедра
- перфорантные вены подколенной ямки
- перфорантные вены латеральной поверхности бедра
- перфорантные вены латеральной поверхности голени
- МПВ, через краниальное продолжение МПВ (т.н. вена Джиакомини)
Хирургическая тактика при проксимальном рефлюксе заключается в ЭВЛО приустьевого сегмента БПВ. Однако, поскольку БПВ в верхней части бедра залегает достаточно глубоко, часто возникает техническая сложность в её пункции, особенно у тучных людей. В такой ситуации мы используем ангиографический катетер размером 5 F, который вводим через мобилизованный варикозно расширенный приток, дренирующий рефлюкс из БПВ. При кольцеобразно замкнутом рефлюксе (рис.67), пункция БПВ и введение в неё световода производится в самой дистальной точке распространения рефлюкса (как правило, это область коленного сустава или верхняя часть голени). При выполнении ЭВЛО такой вены мы облитерируем всё её сегменты на бедре, вне зависимости от наличия или отсутствия в них патологического рефлюкса крови.
ПУТИ ПАТОЛОГИЧЕСКОГО ТОКА КРОВИ ПРИ
РАСПРОСТАНЁННОМ РЕФЛЮКСЕ В СТВОЛЕ БПВ
Распространённый рефлюкс крови по БПВ у больных с начальными формами ВРВНК, встречается, по нашим данным, примерно у 12 %. Этот тип поражения ствола БПВ несколько более разнообразен, чем предыдущий.
Источником рефлюкса здесь, как впрочем и в предыдущих вариантах, в абсолютном большинстве случаев служит остиальный клапан. Далее рефлюкс может распространяться по притокам в трёх главных направлениях:
- перфорантные вены медиальной поверхности голени
- передние перфорантные вены голени
- перфорантные вены латеральной поверхности голени
- малая подкожная вена, задние перфорантные вены голени
 В перфорантные вены медиальной поверхности голени (редко – бедра) обратный поток крови попадает, как правило, проходя по ЗДБПВ (рис.68).
В перфорантные вены медиальной поверхности голени (редко – бедра) обратный поток крови попадает, как правило, проходя по ЗДБПВ (рис.68).
Рис. 68. Распространённый рефлюкс в стволе БПВ, через заднюю добавочную БПВ, дренирующийся в перфораную вену заднебольшеберцовой группы.
Несколько реже связь с этими перфорантами имеет непосредственно сам ствол БПВ. В этой ситуации всё равно можно найти и выделить короткий приток, который связывает перфорантную вену с основным стволом БПВ (рис.56).
 Рис. 69. Распространённый рефлюкс в стволе БПВ, дренирующийся в перфорантную вену приводящего канала.
Рис. 69. Распространённый рефлюкс в стволе БПВ, дренирующийся в перфорантную вену приводящего канала.
Часто при варианте, изображенном на рисунке 69, перфорантные вены приводящего канала имеют значительный диаметр и несостоятельный клапанный аппарат. Поэтому в случае выявления у пациента такого клинического варианта, ЭВЛО БПВ мы всегда дополняем ЭВЛО перфорантной вены приводящего канала. При этом пункцию БПВ всегда выполняем дистальнее точки её соединения с перфорантной веной и, для уменьшения возможности реканализации, в этом сегменте БПВ создаём линейную плотность потока энергии не менее 250 Дж/см для излучения длиной волны 1030 нм и 100 Дж/см для 1470 нм..
Существует вариант, при котором рефлюкс из ствола БПВ через переднюю добавочную БПВ или переднюю огибающую бедро вену дренируется в глубокую систему через перфорантные вены латеральной поверхности голени (реже – бедра). На рисунке 70 представлена схема патологического кровотока в поверхностных венах при описываемой ситуации. Тактика ЭВЛО при таком варианте строения описана в разделе варикозного расширения вен латеральной поверхности.
 Рис. 70. Распространённый рефлюкс в стволе БПВ, дренирующийся через переднюю огибающую бедро вену в перфорантную вену латеральной поверхности голени.
Рис. 70. Распространённый рефлюкс в стволе БПВ, дренирующийся через переднюю огибающую бедро вену в перфорантную вену латеральной поверхности голени.
В следующем рассматриваемом варианте рефлюкс из БПВ может дренироваться в междуглавую перфорантную вену икроножной мышцы и частично в МПВ (рис.71).

Рис. 71. Распространённый рефлюкс в стволе БПВ, через короткий приток дренирующийся в междуглавую перфорантную вену икроножной мышцы и частично в МПВ.
Примерно у 1% больных с распространённым рефлюксом по БПВ переток крови в МПВ создаёт локальную несостоятельность её клапанного аппарата в месте впадения межсафенной вены. В этом случае локальный рефлюкс в МПВ мы никогда не ликвидируем, так как устранение патологического сброса крови по БПВ, которое происходит в результате ЭВЛО, полностью устраняет и сброс крови в МПВ. После выполнения ЭВЛО БПВ у таких больных уже на вторые сутки после операции уменьшается диаметр МПВ и исчезает патологический рефлюкс крови в ней.
Кроме описанных, встречаются смешанные варианты, при которых отток крови в глубокую систему происходит по всем трём описанным направлениям (рис.72).
 Рис. 72. Распространённый рефлюкс в стволе БПВ, дренирующийся в глубокую систему через три разные группы перфорантных вен: перфорантные вены латеральной, медиальной поверхностей голени и междуглавую перфорантную вену икроножной мышцы (также частично в МПВ).
Рис. 72. Распространённый рефлюкс в стволе БПВ, дренирующийся в глубокую систему через три разные группы перфорантных вен: перфорантные вены латеральной, медиальной поверхностей голени и междуглавую перфорантную вену икроножной мышцы (также частично в МПВ).
ПУТИ ПАТОЛОГИЧЕСКОГО ТОКА КРОВИ ПРИ СУБТОТАЛЬНОМ РЕФЛЮКСЕ В СТВОЛЕ БПВ
При субтотальном рефлюксе крови по БПВ, кроме перечисленных выше вариантов, дренаж крови в глубокую систему может осуществляться также и через более дистально расположенные, в частности, окололодыжечные перфорантные вены.
- медиальные перфорантные вены лодыжки
- передние перфорантные вены лодыжки
- латеральные перфорантные вены лодыжки
 Рис. 73. Рефлюкс из БПВ дренируется в глубокую венозную систему через единичную перфорантную вену медиальной поверхности голени.
Рис. 73. Рефлюкс из БПВ дренируется в глубокую венозную систему через единичную перфорантную вену медиальной поверхности голени.
В запущенных стадиях варикозной болезни, для разгрузки поверхностной венозной сети подключаются практически все группы перфорантных вен голени (рис.74).
 Рис. 74. Рефлюкс из БПВ дренируется в глубокую венозную систему через все группы перфорантных вен голени
Рис. 74. Рефлюкс из БПВ дренируется в глубокую венозную систему через все группы перфорантных вен голени
Хирургическая тактика при субтотальном рефлюксе по БПВ определяется, прежде всего, характером расширения ствола БПВ. Наличие множественных эктазий, особенно в сочетании с большим числом варикозно расширенных притоков, зачастую становится ограничением к применению ЭВЛО. При субтотальном рефлюксе большое значение приобретает состояние перфорантных вен. Во время предоперационной разметки под ультразвуковым контролем нужно особенно внимательно оценить состояние всех групп перфорантных вен, дренирующих кровь в глубокую систему вен из бассейна БПВ. При выявлении их клапанной недостаточности мы выполняем одновременно ЭВЛО БПВ и перфорантных вен.
У 25% больных с субтотальным рефлюксом по БПВ переток крови в МПВ также создаёт локальную несостоятельность её клапанного аппарата в месте впадения межсафенной вены. При этом межсафенная вена в 99% случаев имеет сообщение с перфорантной веной, проходящей между головками икроножной мышцы. В этом случае локальный рефлюкс в МПВ мы, также как и в случае распространённого рефлюкса, не ликвидируем. Однако, перфорантная вена, при наличии недостаточности её клапанного аппарата, может в будущем стать источником рецидива. Об этом следует помнить, и при сомнениях в отношении состоятельности её клапанов, выполнить ЭВЛО этого перфоранта.
ПУТИ ПАТОЛОГИЧЕСКОГО ОБРАТНОГО
ТОКА КРОВИ ПРИ ТОТАЛЬНОМ РЕФЛЮКСЕ В СТВОЛЕ БПВ
Тотальный рефлюкс по БПВ наблюдается достаточно редко, в наших наблюдениях примерно у 3% больных с ВРВНК. Такой низкий процент несомненно обусловлен особенностями анатомического строения БПВ в нижней трети голени. В филогенезе человека переход к прямохождению привёл к значительному удлинению бедра. Голень практически не претерпела удлинения, может быть, в этом кроется одна из причин мощного фасциального футляра в нижней её части. Именно этот футляр предохраняет ствол БПВ от варикозной трансформации, обуславливая столь низкий процент рефлюксов в этом сегменте.
При тотальном рефлюксе в стволе БПВ, кроме вышеперечисленных перфорантных вен, в отток крови в глубокую систему включаются перфорантные вены стопы. Таким образом, при тотальном рефлюксе крови по БПВ маршруты дренажа избыточной крови в глубокую систему могут пролегать практически через все группы перфорантных вен конечности (рис.75).
 Рис. 75. Рефлюкс из БПВ дренируется в глубокую венозную систему через все группы перфорантных вен голени, а также медиальную перфорантную вену стопы.
Рис. 75. Рефлюкс из БПВ дренируется в глубокую венозную систему через все группы перфорантных вен голени, а также медиальную перфорантную вену стопы.
Тотальный рефлюкс в БПВ, как правило, возникает в запущенных стадиях варикозного расширения вен нижних конечностей, когда из-за больших диаметров БПВ выполнять её ЭВЛО нецелесообразно. Однако, принимая во внимание миниинвазивность методики, иногда, например, при трофических язвах, имеет смысл выполнить ЭВЛО БПВ, как один их этапов комплексного лечения. В этом случае мы никогда не выполняем ЭВЛО до лодыжки, так как плохое кровоснабжение в нижней трети голени, усугубленное наличием венозного застоя, может привести к осложнениям со стороны местных тканей. Кроме этого, чувствительный подкожный нерв, интимно прилегающий к БПВ в нижней половине голени, будет неизбежно повреждён при ЭВЛО, что может доставить дополнительные страдания больному. Во всех ситуациях тотального рефлюкса в стволе БПВ мы выполняем ЭВЛО от остиального клапана до средней трети голени, не доходя до зоны трофических расстройств.
ПУТИ ПАТОЛОГИЧЕСКОГО ОБРАТНОГО
ТОКА КРОВИ ПРИ ЛОКАЛЬНОМ РЕФЛЮКСЕ В СТВОЛЕ БПВ
Все случаи локального рефлюкса в стволе БПВ удобно подразделить на три группы, в зависимости от его анатомической локализации: на бедре, в области коленного сустава и в области голени.
Локальный рефлюкс в стволе БПВ на бедре:
Наиболее частым источником такого рефлюкса является передняя добавочная БПВ, передняя огибающая бедро вена или задняя добавочная БПВ (рис.76). Реже таким источником служит задняя огибающая бедро вена. В этом случае она часто дренируется в МПВ (и носит название — вена Джиакомини), либо — самостоятельно через отдельный перфорант в подколенную вену.
 Рис. 76. Задняя добавочная БПВ, патологически избыточным объёмом крови переполняет ствол БПВ, где возникает локальный рефлюкс. Дренируется рефлюкс в глубокую систему вен через перфорантную вену заднебольшеберцовой группы.
Рис. 76. Задняя добавочная БПВ, патологически избыточным объёмом крови переполняет ствол БПВ, где возникает локальный рефлюкс. Дренируется рефлюкс в глубокую систему вен через перфорантную вену заднебольшеберцовой группы.
Хирургическая тактика в отношении локальных рефлюксов в стволе БПВ может быть разной: во-первых, можно выполнить ЭВЛО от остиального клапана до нижней границы рефлюкса, во-вторых, можно выполнить только минифлебэктомию (или склеротерапию) варикозно расширенных притоков. Второй вариант нам представляется более предпочтительным, так как при этом сохранённый ствол БПВ, освобождённый от постоянного переполнения избыточным объёмом крови, как правило, уменьшается в диаметре, и в нём восстанавливается функция клапанов.
 Рис. 77. Задняя, огибающая бедро вена патологически избыточным объёмом крови переполняет ствол БПВ, где возникает локальный рефлюкс. Дренируется рефлюкс в глубокую систему вен через МПВ или перфорантную вену подколенной ямки.
Рис. 77. Задняя, огибающая бедро вена патологически избыточным объёмом крови переполняет ствол БПВ, где возникает локальный рефлюкс. Дренируется рефлюкс в глубокую систему вен через МПВ или перфорантную вену подколенной ямки.
Однако вероятность такого благоприятного исхода зависит от того, насколько выражен деструктивнй процесс в стенке вены, с одной стороны, и какой объёмный кровоток проходит через этот участок, с другой стороны. Оценивать это следует только индивидуально у каждого больного.

Рис. 78. Рефлюкс из перфорантной вены приводящего канала в ствол БПВ, далее дренируется в глубокую венозную систему через перфорантные вены голени
Следует знать, что при неправильной оценке изменений в стенке вены, варикозный процесс будет прогрессировать и быстро приведёт к рецидиву. В то же время, при неправильной оценке объёмного кровотока, его резкое снижение, обусловленное удалением притоков, может спровоцировать тромбофлебит в стволе БПВ.
Отдельно стоят случаи локального рефлюкса по БПВ, при котором источником рефлюкса является недостаточный перфорант приводящего канала (перфорант Додда – рис.78).
При таком варианте, мы всегда выполняем ЭВЛО перфорантной вены приводящего канала, с одновременным ЭВЛО ствола БПВ от остиального клапана до нижней границы рефлюкса.
5.2 Анатомическая классификация вариантов строения и патологических рефлюксов в системе малой подкожной вены.
Малая подкожная вена отличается значительной вариабельностью как расположения, так и места впадения. Эта вариабельность создаёт сложности как при её описании в протоколах ультразвуковых исследований, так и при хирургическом устранении рефлюкса в ней. Существует несколько классификаций строения МПВ. Основой большинства из них служит классификация C. Kosinski, предложенная ещё в 1926 году. Изучение анатомии венозной сети производилось им на трупах, путём инъекций красителей и последующим анатомическим препарированием. К сожалению, в то время не было единой концепции флебогемодинамики при ВРВНК, недостаточно осознавалась роль патологических рефлюксов крови, поэтому классификация создавалась для максимально полного хирургического удаления вены и её притоков. В 2005 году D. Creton, на основании изучения ультразвуковой анатомии, усовершенствовал данную классификацию. Важно отметить, что предложенная им классификация впервые признавала наличие эмбриологических особенностей развития МПВ. При этом была предложена оригинальная гипотеза о причинах возникновения её клапанной недостаточности. Автор разделил уровни образования СПС на три типа: тип I – от подколенной складки до точки на 7 см выше неё; тип II – выше подколенной складки более чем на 7 см; тип III – ниже подколенной складки. К сожалению, данная классификация имеет ряд недостатков. Во-первых, рост и, соответственно, длина конечностей и всех людей – разная. Для низкорослых 7 см могут составлять до трети длины бедра, и на этом уровне у них будет уже не подколенная, а поверхностная бедренная вена. Поэтому, для первых двух типов следовало бы найти более строгий анатомический ориентир. Таким ориентиром мог бы стать проксимальный край подколенной ямки, который у человека среднего роста находится как раз на 7-8 см выше одноимённой складки. Однако проксимальнее подколенной ямки существование СПС уже невозможно, так как там вена входит в бедренно-подколенный канал и носит название бедренной вены. Во-вторых, употребление в классификации числительных (тип I, II, III), не несёт смысловой нагрузки и представляет сложность для запоминания. Кроме этого, с формальнологической точки зрения, данная классификация вообще классификацией не является – потому, что любую числовую последовательность можно произвольно разделить на произвольное количество частей.
С нашей точки зрения все анатомические варианты расположения МПВ целесообразно разделить на два типа: с наличием сафенопоплитеального соустья и без сафено-поплитеального соустья. При таком подходе, возникает простая дихотомическая классификация, которая, на наш взгляд, удобнее многих, предложенных ранее. Основная её цель – обоснование подходов к устранению патологических рефлюксов крови в бассейне МПВ.
АНАТОМИЧЕСКАЯ КЛАССИФИКАЦИЯ ВАРИАНТОВ СТРОЕНИЯ ТЕРМИНАЛЬНОГО ОТДЕЛА МПВ:
I. С образованием сафено-поплитеального соустья
1. С прямым впадением МПВ в ПкВ
а) с наличием краниального продолжения МПВ
б) без наличия краниального продолжения МПВ
2. С наличием вены-анастомоза, являющейся СПС
а) с наличием краниального продолжения МПВ
б) без краниального продолжения МПВ
II. Без образования сафено-поплитеального соустья
1. С впадением МПВ в мышечные вены голени
2. С впадением МПВ в БПВ
3. С впадением МПВ в глубокие вены бедра
Данная классификация позволяет выработать единые подходы к хирургическому лечению ВРВНК в бассейне МПВ, в том числе и при эндовенозных способах её облитерации. Мы сознательно не включили в данную классификацию уровень образования СПС. Одна из причин этого заключается в следующем: вариабельность данного уровня в пределах подколенной ямки — чрезвычайно широка, и не только по высоте, а по двум осям одновременно, что не упоминается многими авторами классификаций. В то же время вены, расположенные вне подколенной ямки, не являются подколенной веной, соответственно, за пределами этого анатомического образования не может быть СПС. Если принять за ось абсцисс подколенную складку, а за ось ординат – срединную линию конечности, то можно наблюдать множество координат как перфорации МПВ глубокой фасции (что важно при хирургическом доступе к СПС), так и образования самого СПС. Исходя из этого, разделение СПС на типы только в одном измерении будет бесполезным при решении хирургических задач. В то же время разделение всех вариантов строения терминального отдела МПВ в двух- и, тем более, трёхмерном пространстве будет бесполезным из-за своей громоздкости. Главным же аргументом отказа от включения уровня образования СПС в данную классификацию является то, что классификация должна помочь выработать единые подходы к хирургическому лечению, а не указывать точку, через которую следует проводить разрез у конкретного больного. Эту частную задачу может решить выполнение предоперационной разметки под ультразвуковым контролем.
СТРОЕНИЕ МПВ И ПУТИ РАСПРОСТРАНЕНИЯ РЕФЛЮКСОВ В НЕЙ ПРИ НАЛИЧИИ СПС
В МПВ, так же как и в БПВ следует выделить пять типов распространения рефлюксов:
- проксимальный
- распространенный
- субтотальный
- тотальный
- локальный

а. Проксимальный б. Распространенный в. Субтотальный
рефлюкс рефлюкс рефлюкс

г. Тотальный д. Локальный
рефлюкс рефлюкс
Рис. 79. Варианты распространения рефлюксов крови в стволе МПВ.
ОСОБЕННОСТИ РАЗЛИЧНЫХ ТОПОГРАФОАНАТОМИЧЕСКИХ ВАРИАНТОВ МПВ С НАЛИЧИЕМ СПС.
1. С прямым впадением МПВ в ПкВ
В половине случаев строение проксимального отрезка МПВ представлено этим типом строения. При этом краниальное продолжение МПВ может как присутствовать (рис. 80), так и отсутствовать (рис . 81).

Рис. 80б. Прямое впадение МПВ в ПкВ. Краниальное продолжение МПВ отсутствует.
Рис. 80а. Прямое впадение МПВ в ПкВ. Краниальное продолжение МПВ отсутствует.

Рис. 81б. Прямое впадение МПВ в ПкВ. Краниальное продолжение МПВ.
Рис. 81а. Прямое впадение МПВ в ПкВ. Имеется краниальное продолжение МПВ.
При ЭВЛО МПВ, с описанным строением терминального отдела, мы позиционируем рабочую часть световода в краниальное продолжение МПВ, а если оно отсутствует, то в двух сантиметрах от ПкВ. Прямое впадение МПВ в ПкВ несёт определённую угрозу введения световода в глубокую систему вен, поэтому следует быть особенно внимательным во время позиционирования.
2. С наличием вены, являющейся СПС
При таком варианте строения, от МПВ к ПкВ отходит вена-анастомоз, часто меньше МПВ в диаметре. Кроме того, эта вена иногда имеет очень замысловатый ход и, изгибаясь, она может впадать в ПкВ в неожиданных местах (рис 82).

а) СПС в виде вены-анастомоза б) СПС в виде вены-анастомоза
между МПВ и ПкВ. Краниальное между МПВ и ПкВ. Имеется
продолжение МПВ отсутствует краниальное продолжение МПВ.
Рис. 82. Вариант СПС в виде вены-анастомоза между МПВ и ПкВ.
Учитывая, что в вену-анастомоз между МПВ и ПкВ ввести световод технически бывает очень сложно, а иногда и невозможно, при ЭВЛО МПВ в данной ситуации мы позиционируем рабочую часть световода в месте впадения вены-анастомоза в МПВ. При наличии краниального продолжения МПВ, световод следует вводить в него.
ОСОБЕННОСТИ РАЗЛИЧНЫХ ТОПОГРАФОАНАТОМИЧЕСКИХ ВАРИАНТОВ МПВ ПРИ ОТСУТСТВИИ СПС.
 Рис. 83. Впадение МПВ в венозный синус медиальной головки икроножной мышцы.
Рис. 83. Впадение МПВ в венозный синус медиальной головки икроножной мышцы.
При ЭВЛО МПВ, когда отсутствует СПС, а МПВ дренируется в перфорантную вену голени (рис. 83), мы рекомендуем позиционировать рабочую часть световода в перфорантной вене на уровне мышечной фасции. В случае большого калибра перфорантной вены, при её диаметре, составляющем 8 мм и более, мы рекомендуем выполнять её перевязку из отдельного разреза.

Рис. 84. Впадение МПВ в ствол БПВ.
При варианте строения, когда отсутствует СПС, а МПВ дренируется в БПВ (рис.84), мы рекомендуем позиционировать рабочую часть световода на расстоянии 0,5 см от сафено-сафенного соустья..

Рис. 85. Впадение МПВ в перфорантные вены, соединяющие с глубокими венами бедра.
При ЭВЛО МПВ в данной ситуации (рис. 85) мы рекомендуем позиционировать рабочую часть световода в краниальное продолжение МПВ. При наличии несостоятельных перфорантных вен по задней поверхности беда, следует выполнить ЭВЛО этих перфорантных вен из отдельных проколов, или, при большом диаметре, перевязывать их.
ОСОБЕННОСТИ СТРОЕНИЯ И ТОПОГРАФИИ ПОВЕРХНОСТНОЙ ДОБАВОЧНОЙ МПВ
 Поверхностная добавочная МПВ впадает в ПкВ через отдельную перфорантную вену (так называемая вена Тьери), расположенную в подколенной ямке, как правило, проксимальнее СПС. Следует помнить, что эта перфорантная вена часто имеет значительный диаметр (1 см и более). Поэтому мы в своей работе редко применяем её ЭВЛО, и рекомендуем при диаметре в 8 мм и более перевязывать её из отдельного мини разреза или прокола кожи длиной 2-3 мм. Далее ПДМПВ удаляется методом минифлебэктомии.
Поверхностная добавочная МПВ впадает в ПкВ через отдельную перфорантную вену (так называемая вена Тьери), расположенную в подколенной ямке, как правило, проксимальнее СПС. Следует помнить, что эта перфорантная вена часто имеет значительный диаметр (1 см и более). Поэтому мы в своей работе редко применяем её ЭВЛО, и рекомендуем при диаметре в 8 мм и более перевязывать её из отдельного мини разреза или прокола кожи длиной 2-3 мм. Далее ПДМПВ удаляется методом минифлебэктомии.
Рис. 86. Поверхностная добавочная МПВ.
5.3. Анатомия и пути распространения рефлюксов крови в латеральной венозной системе.
При варикозной болезни патологические изменения возникают во всех отделах единой венозной системы нижних конечностей (Аскерханов Р.П., 1973; Веденский А.Н., 1983; Савельев В.С. с соавт., 2001), условно разделяемой анатомами на поверхностные, перфорантные и глубокие вены. Соответственно тому, в каких венах происходят наибольшие патологические изменения, В.С.Савельев (1972) выделил три формы варикозной болезни нижних конечностей: поверхностную, глубокую и смешанную. Он также отдельно отметил, что существуют атипичные формы варикозной болезни, к которым относится варикозное расширение вен на латеральной поверхности нижних конечностей. По его данным, подобная форма встретилась у 1,5% больных варикозной болезнью нижних конечностей, а по данным литературы, частота ее колеблется от 0,5% (И.В.Червяков) до 6,2% (G. Goren et A.E Gellini).
Некоторые авторы считают, что подкожные вены наружной поверхности нижних конечностей могут быть представлены обособленной венозной системой, в случае задержки редукции латеральной подкожной вены, существующей в эмбриональном периоде (Гладких В.Г., 1971; Albanese A.K. 1969). Dodd H.(1976) полагает, что причиной развития варикозного расширения вен латеральной поверхности нижних конечностей служит несостоятельность клапанов наружной вены, окружающей бедренную кость (v.circumflexa femoris lateralis). А.Н.Веденский (1983) отмечает, что патологические расширения поверхностных вен наружной поверхности нижней конечности гораздо ближе к ангиодисплазиям, чем к варикозной болезни. Подтверждение этому мы находим в работах, посвященных врожденным заболеваниям магистральных вен у детей.
По мнению Д.Д.Купатадзе (1992) существуют два различных типа дисплазий магистральных вен, которые могут быть объяснены особенностями эмбриогенеза сосудов конечностей: эмбриональный (синдром Клиппель-Тренноне) и фетальный. По наличию тех или иных симптомов (нарушения формы, размеров, функции конечности, сосудистые пятна, атипичные вены, признаки хронической венозной недостаточности, ДВС-синдром, поражение сосудов мочеполовой системы и кишечника) Д.Д.Купатадзе (1992) выделил 4 степени тяжести заболевания у детей с эмбриональным типом дисплазии магистральных вен – легкая, средняя, тяжелая, крайне тяжелая. Для легкой степени тяжести поражения характерно наличие только атипичных, эмбриональных вен, гладких сосудистых пятен (редко), отсутствие ХВН. У этих больных, как правило, не удается выявить какие-либо патологические изменения в глубоких венах конечностей. Такая клиническая картина характерна и для больных латеральным варикозом (наличие варикозно расширенных вен на латеральной поверхности нижних конечностей, отсутствие признаков ХВН и часто патологических изменений в большой подкожной вене).
По этим причинам многие авторы варикозно расширенные вены латеральной поверхности нижних конечностей выделяют в отдельную форму варикозной болезни, отмечая, что вероятной причиной их появления могут быть аномалии развития вен нижних конечностей.
Описаны различные варианты латеральной формы варикозной болезни нижних конечностей. Так Гладких В.Г. (1977) выделил следующие клинико-анатомические варианты этой патологии вен: 1) изолированный варикоз латеральных подкожных вен; 2) относительно изолированный варикоз латеральных подкожных вен, сочетающийся с варикозным расширением большой или малой подкожных вен; 3) варикозное расширение латеральных подкожных вен, сопутствующее варикозу большой или малой подкожных вен.
И.В.Червяков (1978) в латеральном варикозе различал два вида: 1) истинный латеральный варикоз, когда имеется задержка редукции эмбриональной латеральной вены с отчетливо определяемым на наружной поверхности бедра рефлюксом из глубоких вен; 2) ложный латеральный варикоз, когда имеется лишь варикозное расширение мелких притоков большой и малой подкожных вен, собирающих кровь с наружной поверхности голени, без задержки редукции эмбриональной латеральной вены. Истинный латеральный варикоз может быть изолированным или может сочетаться с варикозом большой и малой подкожных вен. Ложный латеральный варикоз И.В.Червяков (1978) обнаружил у 15% больных варикозной болезнью нижних конечностей. Как при истинном, так и при ложном латеральном варикозе на наружной поверхности нижних конечностей автор всегда обнаруживал недостаточные коммуникантные вены.

Рис. 87. Тип I латеральной формы варикозного расширения вен. Латеральная вена впадает в БПВ. Источником рефлюкса служит БПВ, в глубокую систему вен рефлюкс дренируется через перфорантные вены латеральной поверхности голени.
Наиболее распространенная классификация латеральной формы варикозного расширения вен нижних конечностей была предложена в 1997 году J.Weber. Все анатомические варианты при этой форме заболевания автор разделил на 5 типов, в зависимости от источника рефлюкса в латеральную вену (рис.87-92).
При типе I латеральной формы варикозного расширения вен, латеральная вена может впадать в БПВ на разных уровнях – от остиального клапана, до коленного сустава.
Распространёние рефлюкса может происходить в трёх сменяющих друг друга вариантах (рис.72). При начальных формах этого заболевания не редко встречается рефлюкс, изолированный в варикозно расширенном латеральным притоке. Чаще всего рефлюкс распространяется по БПВ от остиального клапана до латерального притока, далее «уходит» в него (рис.72б). Часть ствола БПВ, лежащая дистальнее устья латеральной вены, сохраняется интактной длительное время, часто – годы. Этим обусловлено частое отсутствие признаков ХВН при выраженном расширении вен в бассейне латерального притока. По прошествии времени, в следствие постоянного переполнения избыточным объёмом крови из впадающей латеральной вены, появляется недостаточность клапанов дистальнее лежащей части БПВ (рис.72в).
 а – рефлюкс изолированный в латеральной вене
а – рефлюкс изолированный в латеральной вене
б – проксимальный рефлюкс в БПВ, «уходящий» в латеральную вену.
в – рефлюкс в БПВ, «уходящий» в латеральную вену и распространяющийся дистальнее по стволу БПВ
Рис. 88. Различные варианты распространения патологических рефлюксов крови в стволе БПВ при латеральной форме варикозного расширения вен.
В случае изолированного рефлюкса в латеральном притоке, мы выполняем минифлебэктомию этого притока, без ЭВЛО БПВ. При прочих вариантах (рис.88б,в) выполняется ЭВЛО БПВ до нижней границы патологического рефлюкса. Расширенный приток удаляется методом минифлебэктомии или микропенной склеротерапии.
При типе II латеральной формы варикозного расширения вен источником рефлюкса в латеральную вену служит БПВ, а также недостаточный перфорант , соединяющий её с ГВБ (рис.89). В глубокую систему вен рефлюкс дренируется через перфорантные вены латеральной поверхности голени.

Рис. 89. Тип II латеральной формы варикозного расширения вен. Латеральная вена впадает в БПВ. Источником рефлюкса служит БПВ и перфорантная вена, соединяющая латеральную вену с ГВБ.
При типе III латеральной формы варикозного расширения вен источником рефлюкса в латеральную систему служит БПВ, а также недостаточные перфоранты, соединяющие латеральную вену с ГВБ и ПкВ (рис.90).

Рис.90. Тип III латеральной формы варикозного расширения вен. Латеральная вена впадает в БПВ. Источником рефлюкса служит БПВ и перфорантные вены, соединяющие латеральную вену с ГВБ и ПкВ.
В глубокую систему вен рефлюкс дренируется через перфорантные вены латеральной поверхности голени.
При типе IV латеральной формы варикозного расширения вен источником рефлюкса в латеральную систему служат недостаточные перфоранты, соединяющие латеральную вену с ГВБ и НЯВ (рис.91). Связи с БПВ латеральная вена, в этой ситуации, не имеет. В глубокую систему вен рефлюкс дренируется через перфорантные вены латеральной поверхности голени.
 Рис. 91. Тип IV латеральной формы варикозного расширения вен. Латеральная вена не имеет соединений с БПВ. Источником рефлюкса служат недостаточные перфоранты, соединяющие латеральную вену с ГВБ и НЯВ.
Рис. 91. Тип IV латеральной формы варикозного расширения вен. Латеральная вена не имеет соединений с БПВ. Источником рефлюкса служат недостаточные перфоранты, соединяющие латеральную вену с ГВБ и НЯВ.
При типе V латеральной формы варикозного расширения вен основным источником рефлюкса в латеральную систему служит прямой коммуникант с ВПВ. Как и в предыдущем варианте, имеются недостаточные перфоранты, соединяющие латеральную вену с ГВБ и НЯВ (рис.92). Связи с БПВ латеральная вена, в этой ситуации, не имеет. В глубокую систему вен рефлюкс дренируется через перфорантные вены латеральной поверхности голени.
При II – V типах латеральной формы варикозной болезни перфорантные вены, как правило, имеют большой калибр, достигающий 1 см в диаметре и более. Поэтому выполнение ЭВЛО при II – V типах латеральной формы варикозной болезни, с нашей точки зрения, целесообразно далеко не всегда.

Рис. 92. Тип V латеральной формы варикозного расширения вен. Латеральная вена не имеет соединений с БПВ. Главным источником рефлюкса в латеральную систему служит прямой коммуникант с ВПВ. Имеются недостаточные перфоранты, соединяющие латеральную вену с ГВБ и НЯВ.
Все больные с латеральной формой варикозного расширения вен должны в обязательном порядке пройти, как минимум, целенаправленное УЗАС глубоких вен нижних конечностей. Это правило должно неукоснительно соблюдаться, так как под маской латерального варикоза могут протекать разные виды ангиодистлазий, требующие совершенно иного уровня как обследования, так и хирургического пособия.
Внешний вид варикозного расширения вен латеральной поверхности наглядно продемонстрирован на рис.93. Анализируя данные наших клинических исследований, мы смогли выделить следующие клиникоанатомические особенности варикозного расширения вен латеральной поверхности нижних конечностей. Общим для всех этих больных, как правило, является отсутствие трофических нарушений мягких тканей нижних конечностей. Однако, у 3-х пациентов (1,6%), с давностью заболевания более 40 лет, имелись трофические нарушения в виде гиперпигментации, дерматита, трофической язвы голени (соответственно, по одному наблюдению). Следует отметить, что перечисленные трофические изменения у этих больных были на наружной поверхности голени, в нижней ее трети, что нетипично для обычной варикозной болезни. У 5-и пациентов в анамнезе имелись поверхностные тромбофлебиты варикозно расширенных вен латеральной поверхности нижних конечностей.
Клиническая картина течения заболевания бывает разной. У части больных, когда в процесс вовлечена БПВ, варикозное расширение вен наружной поверхности нижних конечностей протекало, как обычная варикозная болезнь. Первые её проявления появлялись в возрасте 2035 лет, причем 63-и из них (47,4%) предъявляли жалобы, характерные для хронической венозной недостаточности: утомляемость, отеки, судороги по ночам в нижних конечностях. 70 больных (52,6%) предъявляли жалобы на наличие косметического дефекта нижних конечностей. У больных этой группы, варикозно расширенные вены определялись на наружной поверхности голени, в области коленного сустава, на границе нижней и средней трети бедра и переходили на переднюю поверхность нижней конечности, впадая в большую подкожную вену в проксимальной трети бедра. У семи пациентов этой группы (5,3%) были трофические изменения в мягких тканях нижних конечностей (дерматит, трофическая язва, тромбофлебит в анамнезе).

Рис. 93. Внешний вид конечности при латеральной форме варикозного расширения вен. У данной пациентки тип I латеральной формы ВРВ с рефлюксом в БПВ от остиального клапана до устья латеральной вены.
Дистальнее ствол БПВ интактный.
У больных второй группы, варикозно расширенные вены наружной поверхности нижних конечностей впервые появились в возрасте 13-15 лет. Однако, многие больные отмечали «усиление» венозного рисунка латеральной поверхности нижних конечностей с детского возраста. Жалобы, характерные для хронической венозной недостаточности, больные не предъявляли, а беспокоил их только косметический дефект нижних конечностей. Однако, у 1-го из 48-и больных этой группы (2,1%), с давностью заболевания 52 года, имелись трофические нарушения мягких тканей нижних конечностей в виде гиперпигментации кожных покровов наружной поверхности голени, но субъективно больного они не беспокоили. У всех больных этой группы варикозно расширенные вены, поднимаясь по наружной поверхности нижней конечности, на границе средней и верхней трети бедра переходили на переднюю поверхность и затем впадали в большую подкожную вену.
Глава 6. Эндовенозная лазерная облитерация в лечении варикозной болезни.
6.1 Краткая характеристика клинических наблюдений.
Опыт применения ЭВЛО в Национальном медико-хирургическом центре им. Н.И. Пирогова в лечении варикозной болезни превышает 3 тысячи пациентов.
В основу настоящего исследования были положены результаты обследования и лечения 1825 больных за последние 5 лет, с учётом освоения современного лазерного оборудования отечественного производства.
Средний возраст больных составил 43,9±12,2 (минимум 17 лет, максимум 73 года). Обследование и лечение осуществлялось как в стационаре, так и в амбулаторно-поликлинических подразделениях Национального медико-хирургического центра им. Н.И. Пирогова.
До операции все пациенты проходили стандартное обследование, обязательно включавшее в себя комплексное ультразвуковое исследование с предоперационной маркировкой. Ультразвуковое ангиосканирование выполнялось на аппаратах Logiqe и Logoq bookxp (США) с режимами дуплексного и триплексного ангиосканирования.
В процессе комплексного ультразвукового исследования, проводимого всем больным, решали следующие задачи:
- определение протяженности и характера структурных изменений магистральных поверхностных вен и их притоков;
- оценка вариабельности диаметра венозных сосудов, их анатомиче-ские взаимоотношения (топографическая анатомия) и функциональные взаимосвязи;
- оценка состояния глубокой венозной системы нижних конечно-стей;
- выявление (локализация) несостоятельных перфорантных (комму-никантных) вен;
После клинического обследования проводилось УЗАС, в положении больного стоя как в состоянии спонтанного кровотока, так и с применением компрессионных проб. Во время исследования датчик перемещался по коже бедра или голени в нужном направлении, что позволяло лоцировать сосуд на всём его протяжении вверх или вниз, легко меняя ультразвуковые срезы тканей от поперечного к продольному – и обратно. В результате формировалось трехмерное представление об архитектонике исследуемой анатомической области. При исследовании диаметров БПВ (МПВ), в положении больного стоя, определяли диаметр максимального расширения вены. Как правило, такое расширение находилось сразу под остиальным клапаном.
Ретроградный сброс крови продолжительностью до 0,5 секунды считали физиологическим; это время необходимо для смыкания функционально полноценных створок венозных клапанов. Обратный ток крови длительностью более 0,5 секунды считали патологическим.
УЗАС у всех пациентов проводили в режиме панэхофлебографии, не ограничиваясь исследованием в стандартных эхографических окнах.
Статистическая обработка результатов исследования проводилось с использованием программного пакета Statistica 6.0.
Для клинической оценки нарушения венозного оттока из нижних конечностей использовалась Международная классификации хронический заболеваний вен нижних конечностей СЕАР последнего пересмотра (B.Eklof, 2006).
Согласно данной классификации, больные были распределены по клиническим формам заболевания следующим образом (табл. 3):
Таблица 3. Распределение больных, оперированных с применением ЭВЛО, в зависимости от пола и клинического класса заболевания по СЕАР
| Клинические классы по СЕАР | Женщины | Мужчины | Всего больных (%) |
| С2 | 1038 | 207 | 1245 (68,0) |
| С3 | 325 | 103 | 428 (23,5) |
| С4 | 89 | 43 | 132 (7,0) |
| С5 | 9 | 5 | 14 (1,0) |
| С6 | 4 | 2 | 6 (0,5) |
| Всего | 1465 | 360 | 1825 (100) |
Как видно из представленных данных, у большинства пациентов заболевание проявлялось наличием варикозно расширенных подкожных вен (класс С2). Почти в три раза меньше было больных класса С3, с наличием отёка.
Трофические изменения, в виде гиперпигментаций и липодерматосклероза, наблюдались у 132 больных, активные или зажившие трофические язвы отмечены были у 20 пациентов. Эти данные наглядно демонстрируют изменившийся в последние годы подход к отбору пациентов для выполнения ЭВЛО. Последние годы, с накоплением опыта, мы стали постепенно сужать показания к ЭВЛО. Следует отметить, что у больных с тяжелыми формами ХВН выполнялись, в основном, ЭВЛО перфорантных вен, как один из этапов комплексного лечения.
У 169 больных имел место рецидив варикозного расширения вен нижних конечностей после проведенного ранее хирургического вмешательства. У всех пациентов с рецидивом возврат заболевания возник спустя несколько лет после оперативного вмешательства (от 6 месяцев до 26 лет).
Таблица 4.
Распределение больных (конечностей), оперированных с применением ЭВЛО
| клинический
класс по СЕАР |
количество
больных (оперировано конечностей) |
количество
ЭВЛО БПВ |
количество
ЭВЛО МПВ |
количество
ЭВЛО ПВ |
| С2 | 1245 (1335) | 1134 | 201 | 78 |
| С3 | 428 (481) | 404 | 77 | 84 |
| С4 | 132 (150) | 126 | 24 | 142 |
| С5 | 14 (14) | 11 | 3 | 22 |
| С6 | 6 (6) | 5 | 1 | 9 |
| Всего: | 1825 (1986) | 1680 | 306 | 335 |
Из 1825 оперированных пациентов, 161 были оперированы на обеих нижних конечностях. Таким образом, ЭВЛО выполнена на 1986 нижних конечностях. При этом ЭВЛО БПВ выполнялось на 1680 конечностях, МПВ – на 306 конечностях. Одновременно было выполнено ЭВЛО 335 перфорантных вен. Распределение больных в зависимости от стадии заболевания и анатомического типа расположения БПВ относительно поверхностной фасции на бедре представлено в таблице 5.
Таблица 5.
Распределение больных (оперированной конечности) по клиническому классу «С» международной классификации СЕАР
| Тип расположения
БПВ |
Клинический класс «С» по СЕАР | Всего | ||||
| С2 | С3 | С4 | С5 | С6 | ||
| i | 498 | 180 | 48 | 4 | 1 | 731 |
| h | 176 | 24 | 18 | 2 | — | 220 |
| s | 330 | 152 | 37 | 7 | 3 | 529 |
| Итого: | 1004 | 356 | 103 | 13 | 4 | 1480 |
Эндовенозная лазерная облитерация БПВ проводилась на 1680, МПВ – на 306 конечностях. Во всех случаях – от СФС и СПС до нижней границы рефлюкса. Это явилось следствием точной топической диагностики и предоперационной разметки конечности непосредственно перед вмешательством под контролем УЗАС.
У 242 больных были произведены ЭВЛО 335 перфорантных вен. Распределение облитерированных перфорантных вен по локализации приведено в таблице 6.
Таблица 6. Распределение облитерированных перфорантных вен по локализации
| локализация перфорантных вен | Клинический класс «С» по СЕАР | Всего | ||||
| С2 | С3 | С4 | С5 | С6 | ||
| Перфорантные вены лодыжки | — | 2 | 1 | 2 | — | 5 |
| Перфорантные вены голени | 72 | 81 | 141 | 20 | 9 | 323 |
| Перфорантные вены бедра | 6 | 1 | — | — | — | 7 |
| Итого: | 78 | 84 | 142 | 22 | 9 | 335 |
Во всех случаях ЭВЛО магистральных подкожных вен дополнялась одномоментным устранением варикозно расширенных притоков. На 48 конечностях выполнялась эхоконтролируемая склерооблитерация притоков. На 1938 конечностях ЭВЛО дополняла минифлебэктомия. Склерооблитерацию производили с помощью микропены 3% этоксисклерола или фибро-вейна. На всю процедуру облитерации использовали не более 10-12 мл пены, которую готовили непосредственно перед введением. Ни в одном случае аллергических реакций отмечено не было.
6.2 Показания и противопоказания к ЭВЛО.
Ни одна методика лечения ВРВНК на сегодняшний день не может быть признана универсальной. Для каждой группы пациентов со схожими проявлениями ВРВНК существует свой, наиболее оптимальный способ лечения. Умение выделить эти группы и определить показания к применению той или иной лечебной технологии у конкретного пациента является важнейшим слагаемым врачебного мастерства.
Для технологии ЭВЛО некоторые показания и противопоказания до сих пор продолжают оставаться предметом дискуссии. Тем не менее, уже определены основные группы пациентов с ВРВНК, для которых возможность успешного использования ЭВЛО никем не оспаривается. Такие группы должны соответствовать следующим критериям:
1. Приустьевое расширение БПВ не более 10 мм. Вены, более широкие в просвете, возможно «закрывать» при помощи ЭВЛО, однако в этих случаях часто получаются неудовлетворительные результаты.
2. Незначительное количество варикозно расширенных притоков. При выраженной варикозной трансформации большого количества подкожных вен объём операции может настолько возрастать, что травма, полученная пациентом за счет стриппинга БПВ (МПВ) становится уже несущественной.
3. Ровный ход ствола БПВ (МПВ). Бывают ситуации, при которых магистральный ствол делает изгиб, который невозможно пройти эндовенозно ни проводником, ни зондом, ни катетером. В данной ситуации можно ввести два световода ниже и выше изгиба. Тем не менее, во время предоперационного ангиосканирования следует оценить ситуацию и взвесить все «за» и «против» ЭВЛО в данном случае.
4. Трофические расстройства голени. Данное показание следует выделить специально для эндовенозной лазерной облитерации перфорантных вен (ЭВЛОПВ). Данный способ ликвидации горизонтального рефлюкса по своей надёжности практически не уступает открытой перевязке и эндоскопической диссекции, выгодно отличаясь от них малой травматичностью и возможностью многократного повторения. ЭВЛОПВ может выполняться в сочетании практически со всеми видами хирургической ликвидации рефлюкса по БПВ и МПВ.
Противопоказания к проведению ЭВЛО можно условно разделить на 2 группы: общего и местного характера.
I. Противопоказания общего характера:
1. Установленная тромбофилия. Поскольку метод ЭВЛО подразумевает образование тромба в непосредственной близости от просвета бедренной или подколенной вены с одномоментной активацией свертывающей системы крови, у таких пациентов существует реальная угроза возникновения тромботического процесса в глубоких венах с последующей тромбоэмболией легочных артерий (ТЭЛА).
2. Хроническая ишемия нижних конечностей (ХИНК). Поскольку одним из этапов технологии ЭВЛО является обязательная компрессия в послеоперационном периоде, то у пациентов с ХИНК она может значительно усугубить имеющеюся ишемию.
3. Сопутствующая патология, требующая первоочередного лечения. Не вызывает сомнений, что наличие у пациента не связанного с ВРВНК заболевания, требующего незамедлительного лечения, позволяет отложить плановое вмешательство по поводу ВРВНК.
4. Невозможность создания адекватной компрессии после вмешательства у пациентов, страдающих ожирением – является относительным противопоказанием для проведения ЭВЛО. Наличие значительных жировых отложений на бедрах, придающих им конусообразную форму, делает невозможным ни ношение компрессионного трикотажа, ни эластичных бинтов так, чтобы поддерживать необходимый уровень давления на бедре. Сюда же следует отнести отказ пациента (явный или нет) от ношения компрессионного трикотажа.
5. Невозможность активизации больного после вмешательства. Лучший способ профилактики послеоперационных тромбоэмболических осложнений – ранняя активизация больного. В идеале технология ЭВЛО требует, чтобы больной сам вставал с операционного стола и ходил в течение определённого времени после вмешательства. У пациентов, которых по разным причинам невозможно активизировать в ранние сроки, безопаснее с этой точки зрения выполнять стриппинг.
В остальных случаях показания и противопоказания могут устанавливаться индивидуально.
II. Противопоказания местного характера:
1. Значительное расширение ствола БПВ. В нашей практике мы полностью отказались от выполнения ЭВЛО при расширении ствола вены более 10 мм. Иногда, в случае диаметра вены от 10 до 12 мм, вопрос решается индивидуально, чаще – в пользу отказа от ЭВЛО. Тем не менее, в литературе можно найти указания на выполнения данного вмешательства при диаметре вены до 18 мм включительно.
2. Наличие очагов воспаления в зоне вмешательства. Небольшие по размерам очаги воспалительных заболеваний кожи и подкожной жировой клетчатки под влиянием операционного стресса могут спровоцировать развитие раневой инфекции.
3. Предшествующая стволовая склеротерапия. В большинстве случаев при реканализации вены после стволовой склеротерапии внутри просвета вены остаётся определённое количество спаек, стриктур и т.п..При этом заведение световода внутрь сосуда иногда сопровождается возникновением технических препятствий, что не позволяет полноценно выполнить ЭВЛО.
Особенности подбора компрессионного трикотажа для ЭВЛО
Этот момент вынесен отдельным пунктом не случайно. От качества наложенного компрессинного бандажа напрямую зависит самочувствие пациента после вмешательства. Поэтому ещё накануне операции пациенту следует правильно подобрать соответствующий компрессионный трикотаж, с которым он должен прибыть в клинику. Лечебный компрессионный трикотаж подбирается в специализированных салонах, где специально обученный этому персонал обмеряет нижнюю конечность больного на разных уровнях. Ориентируясь на эти мерки и степень компрессии, указанную врачом, работник салона выдаёт пациенту необходимое ему изделие.
Компрессионный трикотаж по сравнению с эластичными бинтами имеет существенные преимущества:
— распределение давления не зависит от навыков пациента или врача, а программируется при изготовлении изделия;
— соответствует эстетическим требованиям;
— создает благоприятные условия для водного и температурного ба-ланса кожи конечности;
— возможен выбор оптимального давления в соответствии с компрес-сионным классом изделия.
Медицинский компрессионный трикотаж делятся на 4 класса (в зависимости от создаваемого давления на уровне лодыжки):
класс – 18–21 мм рт.ст.;
класс – 23–32 мм рт.ст.;
класс – 34–46 мм рт.ст.;
класс – выше 49 мм рт.ст..
После выполнения процедуры ЭВЛО пациент должен носить компрессионный трикотаж 2 класса. При его подборе следует исходить из того, что ближайшие 5 суток после вмешательства пациенту не придётся снимать его даже на время ночного сна. Исходя из этого, не стоит назначать компрессионные колготы. Как правило, пациенту рекомендуется приобрести компрессионные чулки. В последние годы мы широко стали использовать компрессионный трикотаж VENOTEKS. Если планируется ЭВЛО БПВ, необходимо чтобы верхний край надетого чулка достигал паховой складки. Это важно для создания необходимого давление по всей длине вены, до сафено-феморального соустья (СФС) включительно. В случае предполагаемой ЭВЛО МПВ иногда бывает достаточно ношения компрессионного гольфа, при этом необходимо удостовериться, что его верхний край достигает сафено-поплитеального соустья (СПС).
Подготовка больного к проведению ЭВЛО
Как правило, специальной подготовки пациента данная методика не требует. Пациенту требуется пройти стандартный скрининг для госпитализации. Перед вмешательством необходимо побрить конечность.
Разметка на коже больного проводится под ультразвуковым контролем непосредственно перед вмешательством. Вначале определяется нижняя граница рефлюкса по БПВ (МПВ). Как правило, эта граница находится в месте впадения крупного притока. В этом месте ставится отметка. Вторая отметка ставится на 3-4 см дистальнее первой. В этом месте будет производиться пункция вены. Затем по ходу БПВ (МПВ) отмечаются все места впадения притоков. Это делается для того, чтобы при ЭВЛО в этих местах выдержать более длительную экспозицию лазерного излучения и «закрыть» устья притоков. Дальше маркируются все варикозно расширенные притоки, независимо от способа, которым они будут удаляться. Для профилактики венозных тромбоэмболических осложнений у больных, входящих в группу риска, мы используем однократное введение профилактической дозы фраксипарина, непосредственно перед вмешательством.
6.3 Техника проведения ЭВЛО.
ШАГ 1. ПУНКЦИЯ МАГИСТРАЛЬНОЙ ПОДКОЖНОЙ ВЕНЫ И ПРОВЕДЕНИЕ СВЕТОВОДА
Обработка операционного поля производится стандартно. Наименее травматичным является пункционный способ введения световода в БПВ (МПВ). Для этого возможно использование специальных ангиографических наборов с катетером диаметром 5F. Использование этих наборов обеспечивает несомненное удобство в работе. Ангиографический катетер позволяет пройти большинство изгибов магистральной вены. Отрицательной стороной этих наборов является их достаточно высокая стоимость. Также не исключена вероятность во время ЭВЛО «отжечь» часть катетера в просвете вены с последующей эмболией легочной артерии. С приобретением необходимого опыта, в своей ежедневной работе мы практически отказались от использования катетеров. При определенных практических навыках не представляет труда провести по магистральной подкожной вене только один световод. Для его введения в вену требуется обычный катетер для внутривенных вливаний в периферические вены.

Пунктируется БПВ (МПВ) внутривенным катетером 18 G под контролем ультразвука. Во время пункции помощник устанавливает ультразвуковой датчик параллельно пунктируемой вене, так, чтобы вена на экране монитора была видна в продольном срезе. Это гораздо удобнее поперечного расположения, так как имеется возможность постоянно держать под контролем
Рис. 94. Пункция БПВострие иглы (рис.94, 95).

Рис. 95. Игла внутривенного катетера заведена в ствол БПВ. Отчетливо визуализируется острие иглы.

Рис. 96. Игла извлечена, и в просвете вены остаётся катетер. Он визуализируется в виде структуры, ограниченной двумя параллельными гиперэхогенными полосками.
Далее в просвет вены через катетер вводится световод (рис.97), который под ультразвуковым контролем или по пилотному лучу устанавливается в зоне СФС (СПС).
Во время проведения по просвету вены, световод должен проходить без усилий. В случае возникновения препятствия для световода, его проведение следует прекратить. Далее в поперечном к вене положении ультразвукового датчика визуализируется торец световода, датчик устанавливается параллельно стволу БПВ. В таком положении легко определить место, в которое упёрся конец световода.
 Как правило, вена в таком месте делает изгиб. Для преодоления изгиба используется несколько простых приёмов.
Как правило, вена в таком месте делает изгиб. Для преодоления изгиба используется несколько простых приёмов.
1. Если световод упирается в заднюю стенку вены, следует отвести его назад на 2-3 мм, затем слегка надавить на световодом, в 5-6 см дистальнее конца световода. При этом световод дугообразно изгибается, а его рабочая часть приподнимается и позиционируется посредине вены или, при большей силе надавливания, у её передней стенки.
Рис. 97. Введение световода в БПВ через кожу в проекции вены со внутривенный катетер.
2. Если световод упирается в переднюю стенку вены, он также отво- дится назад, а надавливание производят непосредственно ультразвуко- вым датчиком. При этом рабочая часть световода отдавливается к задней стенке и может пройти вдоль неё.
3. Если вена совершает изгиб в медиальную или латеральную стороны, торец световода может повредить боковую стенку вены в месте изгиба. Для предупреждения этого, после ощущения возникшего препятствия, световод отводится назад примерно на 2-3 см. Кожа с подкожной клетчаткой захватывается в складку, в которую должны попасть вена со световодом. Далее складка смещается в сторону изгиба до момента, пока на экране монитора не будет чётко виден выпрямленный участок вены перед торцом световода. Не нужно пытаться одномоментным «рывком» пройти изгиб. Световод следует продвигать вперёд плавно и очень мелкими шагами, буквально по миллиметру. Так можно избежать перфорации вены и преодолеть изгиб.
При безуспешности обойти препятствие тотчас выше него устанавливают ещё один световод.
После преодоления всех препятствий световод плавно продвигают в сторону соустья.
ШАГ 2. ПОЗИЦИОНИРОВАНИЕ РАБОЧЕЙ ЧАСТИ СВЕТОВОДА
 После подведения светящейся точки пилотного луча к зоне СФС (рис.98), над этим местом устанавливают датчик и начинают позиционирование рабочей части световода. Используя попеременно поперечное и продольное (по отношению к оси вены) положение датчика ультразвукового сканера, добиваются расположения торца световода superficialis. Сохранение этого верхнего притока многими специалистами расценивается как способ профилактики тромбоза культи БПВ. Тем не менее, в некоторых случаях, возможно введение световода непосредственно в этот приток. При его впадении непосредственно возле остиального клапана, как показано на рисунке 99, возможно «заварить» БПВ вообще без оставления культи. Если так сделать не удается, торец световода позиционируется в 0,5 см от остиального клапана.
После подведения светящейся точки пилотного луча к зоне СФС (рис.98), над этим местом устанавливают датчик и начинают позиционирование рабочей части световода. Используя попеременно поперечное и продольное (по отношению к оси вены) положение датчика ультразвукового сканера, добиваются расположения торца световода superficialis. Сохранение этого верхнего притока многими специалистами расценивается как способ профилактики тромбоза культи БПВ. Тем не менее, в некоторых случаях, возможно введение световода непосредственно в этот приток. При его впадении непосредственно возле остиального клапана, как показано на рисунке 99, возможно «заварить» БПВ вообще без оставления культи. Если так сделать не удается, торец световода позиционируется в 0,5 см от остиального клапана.
Рис. 98. Начало позиционирования рабочей у места впадения v.epigastrica части световода.

Рис. 99. Показан момент подведения световода к соустью.
При работе на МПВ рабочая часть световода позиционируется в 1 см от подколенной вены или вводится в верхний приток МПВ (краниальное продолжение малой подкожной вены – extensio cranialis venae saphenae parvae). Обязателен двойной контроль позиции рабочего торца световода – ультразвуковое изображение и светящийся под кожей пилотный луч (при введении световода в ОБВ свет пилотного луча пропадает). Далее световод фиксируется к коже пластырем.
ШАГ 3. СОЗДАНИЕ ТУМЕСЦЕНТНОЙ АНЕСТЕЗИИ
Следующим шагом создаётся тумесцентная анестезия вокруг ствола БПВ (МПВ). Этот ответственный этап должен проводиться под ультразвуковым контролем. Раствор анестетика вокруг сосуда поглощает тепловую энергию лазерного излучения, предупреждая тем самым повреждение окружающих тканей. Кроме этого, она необходима для адекватного обезболивания. Существуют разные прописи раствора для инфильтрации, мы используем 0,1% раствор лидокаина без примеси адреналина. По опыту работы, адреналин не влияет на качество обезболивания (при правильно выполненной инфильтрации), но создаёт определённые проблемы (тахикардия, повышение артериального давления и др.) у части пациентов. В момент инфильтрации желательно, чтобы остриё иглы практически касалось стенки БПВ (МПВ). В этом случае возможно равномерное распределение раствора в фасциальном футляре БПВ (МПВ). После инфильтрации паравазальных тканей вокруг передней стенки вены иглу продвигают глубже и инфильтрируют ткани вокруг задней стенки сосуда. Таким образом, достигается циркулярная инфильтрация вокруг вены. При правильно созданной тумесцентной анестезии на экране монитора должна быть примерно такая картина, как показано на рисунке 100. Особенно важно правильно создать тумесцентную анестезию в зоне СФС. Она должна защитить расположенные вблизи структуры, прежде всего, бедренную вену от теплового воздействия лазера. Следует убедиться, что раствор в зоне СФС отделяет БПВ от расположенных глубже сосудов. В случае обработки СПС, требования к тумесцентной анестезии аналогичные.

Рис. 100. Правильно созданная тумесцентная анестезия ствола БПВ. Паравазальные ткани инфильтрированы циркулярно. Ярко светящаяся белая точка внутри сосуда – световод.
После того, как оперирующий хирург убедился в адекватности выполненной инфильтрации, следует повторно удостовериться в правильном позиционировании рабочей части световода. Это нужно делать обязательно, так как во время инфильтрации вена сжимается раствором, а рабочий конец световода может сместиться как в дистальном, так и в проксимальном направлении. У нас имеется наблюдение, при котором после создания анестезии рабочая часть оказалась в просвете бедренной вены. Для контроля позиции рабочей части световода очень важно, чтобы при инфильтрации в зоне соустья, производимой на предыдущем этапе, в ткани не попадал воздух из шприца. Загазованность паравазальных тканей создаёт препятствие для ультразвука и может сделать невозможным правильное позиционирование световода. Сразу после окончательного позиционирования рабочей части световода, внутривенный катетер извлекается. Если этого не сделать, сохраняется вероятность забыть сделать это в дальнейшем и пережечь катетер лазером в просвете вены. Описаны случаи миграции отожженной части катетера из БПВ в легочную артерию после проведения ЭВЛО.
ШАГ 4. ПРОВЕДЕНИЕ ЭНДОВЕНОЗНОЙ ЛАЗЕРНОЙ ОБЛИТЕРАЦИИ
Для проведения этого этапа важно правильно выбрать параметры излучения лазера. Здесь и далее описаны параметры для «гемоглобинпоглощаемой» длины волны 1030 нм. Для излучения с длиной волны 1470 нм значения плотности потока энергии уменьшаются в 2,5 раза. Мы применяем мощность излучения от 18 до 25 Вт – при длительности импульса в 900 мс и интервале между импульсами 10 мс (рис.101). Первоначально подаётся один импульс и, окончательно убедившись в правильной позиции световода по выделению газа, подаётся 4-5 импульсов, затем световод отводится на 3 мм назад (шаг), и цикл повторяется. В зоне дуги БПВ, от первой точки до места отхождения наиболее дистального притока, мы создаём плотность потока энергии не менее 200 Дж/см (примерно 10 импульсов на см). Далее от этого места подаётся по 3 импульса на точку, увеличивая длину шага от 3–4 мм (на бедре) до 5-6 мм (область коленного сустава и верхняя треть голени). В месте отхождения наиболее значимых притоков плотность потока энергии должна составлять менее 200 Дж/см. Эти места заранее маркируются на коже, как показано на рис. 98.
 Рис. 101. Параметры лазерного излучения при диаметре вены возле соустья 8 мм. Лазерный аппарат «ЛАМИ» отечественного производства с длиной волны 1030 нм и регулируемой мощностью от 0,25 до 25 Вт.
Рис. 101. Параметры лазерного излучения при диаметре вены возле соустья 8 мм. Лазерный аппарат «ЛАМИ» отечественного производства с длиной волны 1030 нм и регулируемой мощностью от 0,25 до 25 Вт.
Во время проведения ЭВЛО необходим ультразвуковой контроль движущегося световода. На экране монитора ультразвукового сканера при этом хорошо видно образование газа перед рабочей частью световода (рис.102). Приобретение опыта выполнения ЭВЛО позволило нам постепенно отойти от подсчета количества импульсов и производить контроль над процедурой визуально, по характеру газообразования в просвете вены.

Рис. 102. Момент выполнения лазерной облитера- ции. Отчетливо видны рабочая часть световода, газ и вена, с уплотнёнными гиперэхогенными стенками в участке, обработанном лазером.
Всего на облитерацию БПВ от СФС до нижней трети бедра требуется около 300–350 импульсов. В случае проведения ЭВЛО до верхней трети голени количество импульсов должно составлять 400–450. То есть, плотность потока энергии излучения составляет от 100 до 200 Дж на 1 «погонный» см коагулируемой вены. По окончанию процедуры ЭВЛО, хирург прекращает подачу лазерного излучения на расстоянии 1,5–2 см от места прокола кожи, чтобы не вызвать её ожога. Затем световод извлекается из вены. Далее проводится контроль выполненной процедуры. Ультразвуковой датчик вновь устанавливается в проекции СФС (СПС). Проверяется состояние магистральной глубокой вены. Затем, в поперечном положении к оси коагулированной вены, ультразвуковой датчик проводится в дистальном направлении. Проверяется полнота обработки вены и наличие перфораций. При правильно выполненной процедуре коагулированная вена имеет вид кольца с толстыми стенками. Снаружи от стенок определяется узкий гипоэхогенный ободок – остаток раствора анестетика. В центре вены, как правило, определяются включения газа (рис.103).

Рис. 103. МПВ непосредственно после процедуры ЭВЛО. Определяются резко утолщенные стенки вены и точечный просвет, содержащий газ.
ШАГ 5. НАЛОЖЕНИЕ КОМПРЕСИОННОГО БАНДАЖА
Наложение компрессионного бандажа служит двум целям: уменьшению диаметра и созданию своего рода иммобилизации коагулированной вены. При этом создаются условия максимального «покоя» и закрытие просвета вены происходит без явлений флебита. Компрессионный бандаж состоит из двух частей: пелота, укладываемого вдоль коагулированной вены, и компрессионного трикотажа. В качестве пелота очень хорошо зарекомендовал себя липкий фетр, используемый в качестве подкладочного материала под синтетический гипс. Вначале на кожу наклеиваются полоски липкого бинта, чтобы защитить эпидермис от чрезмерного давления. Если этого не сделать, иногда появляются локальные потёртости с отслойкой эпидермиса и образованием пузырей. Затем клеится фетр или подкладывается заранее подготовленный ватно-марлевый жгут. Сверху наклеивается полоса липкого бинта. Поверх пелота одевается компрессионный чулок 2 класса (рис.104).

Рис.104. Надевание компрессионного чулка 2 класса компрессии VENOTEKS.
ОСОБЕННОСТИ ЭВЛО ПЕРФОРАНТНЫХ ВЕН
Перфорантые вены пунктируются под ультразвуковым контролем (рис.105, 106). Катетер заводится в вену, попадание в которую определяется по изображению на экране монитора ультразвукового сканера и поступлению крови из иглы. После заведения световода в перфорант, вокруг него создаётся тумесцентная анестезия. Процесс облитерации отслеживается по изображению на мониторе. При диаметре перфорантной вены в 5 мм мы используем следующий режим ЭВЛО: мощность 20 Вт, длина импульса 900 мс, интервал между импульсами – 10 мс. Учитывая, что перфорантные вены имеют направление хода перпендикулярное к поверхности кожи, коагулировать их на протяжении в нескольких точках технически сложно, а часто и невозможно. Поэтому нами производится облитерация в одной точке, в которую мы подаём от 15 до 20 импульсов (не менее 300 Дж в 1 точку), стараясь полностью разрушить перфорантную вену в этом месте.

Рис. 105. Пункция перфорантной вены под контролем ультразвука..

Рис.106. Игла введена в перфорантную вену.
УДАЛЕНИЕ ВАРИКОЗНО РАСШИРЕННЫХ ПРИТОКОВ
В настоящее время операция Нарата постепенно теряет своих приверженцев. Этому есть две причины: во-первых, притоки небольшого диаметра могут быть подвергнуты склерооблитерации; во-вторых, её стала вытеснять минифлебэктомия. Минифлебэктомия заключается в выведении наружу и удалении варикозно расширенных притоков с помощью специальных крючков различных модификаций из отдельных проколов кожи длиной 1-2 мм (рис.107). Вены при этом не перевязываются, а проколы не требуют ушивания. Гемостаз достигается эластической компрессией. Спустя несколько месяцев послеоперационные кожные рубцы практически не видны. Минифлебэктомию лучше выполнять после процедуры ЭВЛО. Такая очередность связана с тем, что для успешной облитерации вены в просвете сосуда должна содержаться кровь. При выполнении минифлебэктомии, в просвет БПВ часто попадает воздух, пузыри которого могут привести к неоднородности теплового воздействия на венозную стенку.

Рис.107. Минифлебэктомия под местной анестезией.
Более мелкие притоки, а также ретикулярные вены и телеангиоэктазии устраняются при помощи склеротерапии. Склеротерапия – один из наиболее распространённых методов в Европе, всё большую популярность приобретает у нас в стране. Применение склеротерапии позволяет выполнять большие хирургические вмешательства очень быстро и косметично. В комбинации с ЭВЛО используется склеротерапия по микропенной технологии с ультразвуковым контролем. Склерозант вводится точно в заданные притоки, а ультразвуковой контроль позволяет контролировать его распространение до нужного участка венозной сети.
6.4 Ошибки, опасности и осложнения при проведении ЭВЛО.
Как любое хирургическое вмешательство, ЭВЛО имеет свой послеоперационный период. К нормальным проявлениям послеоперационного периода следует отнести:
Тянущие боли вдоль коагулированной магистральной вены, низкой или средней интенсивности. Болевые ощущения исчезают на 2-3 сутки после ЭВЛО и у большинства вновь возникают на 4-7 сутки за счет развития асептического флебита.
Появление кровоподтёков по ходу коагулированной вены. Причи-на появления кровоподтеков кроется как в перфорациях вены (рис.108) при ЭВЛО, так и в чрезмерно выполненной тумесцентной анестезии, когда «ползущий» инфильтрат под давлением разрывает подкожные ткани.
Чувство «хорды» вдоль бедра (при ЭВЛО БПВ). При полном раз-гибании конечности в коленном суставе пациент ощущает натяжение в месте расположения БПВ, мешающее до конца разогнуть конечность.
Как правило, данное ощущение исчезает в сроки до 1,5 месяцев.
Кратковременный подъем температуры до субфебрильных цифр че-рез несколько часов после проведения ЭВЛО отмечается у части пациентов. Этот подъём обусловлен пирогенным действием образовавшихся после ЭВЛО продуктов деградации белков. При необходимости купируется приёмом нестероидных противовоспалительных средств (НПВС).
Довольно редко, преимущественно у пациентов с низким болевым порогом, в первые сутки после ЭВЛО отмечается достаточно интенсивная болезненность в оперированной конечности. Необходимо помнить, что часто такой болевой синдром связан не с операционной травмой, а с неправильно наложенным компрессионным бандажом, который может сильно сдавливать конечность. С тех пор как мы отказались от использования эластичных бинтов в пользу компрессионных чулок, такие жалобы стали редки.

Рис. 108. Перфорация БПВ с образованием гематомы в паравазальных тканях.
Все тактические и технические ошибки, возникающие при выполнении ЭВЛО, а также появляющиеся при этом опасности осложнений мы условно разделили на две группы: «большие» и «малые». Большие ошибки могут отрицательно повлиять на исход лечения, малые – не повлияют на исход лечения, но создадут лишние неудобства как пациенту, так и хирургу.
Тактические ошибки.
К «большим» тактическим ошибкам мы отнесли:
1.1. Выполнение ЭВЛО при диаметре вены более 10 мм. Если во время УЗАС пациент находился в положении лёжа, то БПВ (МПВ) пребывала в спавшемся состоянии, и на поперечном разрезе имела вид эллипса. При этом её передне-задний размер мог уменьшиться на 1/3 часть и более. В заключении специалиста ультразвуковой диагностики диаметр вены в 10 мм, на самом деле, может являться её переднее-задним размером, тогда как в состоянии «круглого сечения» фактический диаметр может быть 13 и более мм. Поэтому УЗАС вен должно проводиться в положении стоя.
1.2. Расположение рабочего торца световода дистальнее, чем это необходимо. Многие хирурги, начинающие осваивать метод ЭВЛО, имеют вполне понятный страх перед возможным повреждением БВ. Из этих соображений рабочий торец световода отводится на расстояние 1,5 см и более от СФС. При этом сохраняются проксимальные притоки БПВ (длинная культя), что значительно увеличивает риск возникновения рецидива.
1.3. Слишком проксимальная катетеризация БПВ с оставлением части ствола БПВ (МПВ) с несостоятельными клапанами. Дистальнее границы рефлюкса БПВ (МПВ) имеет размеры в 2 и более раз меньшие, чем в зоне неработающих клапанов. Иногда при невозможности катетеризировать вену мелкого калибра, катетеризация производится проксимальнее, там, где удобнее. Это приводит к сохранению участка ствола магистральной вены с несостоятельными клапанами, что также может явиться источником рецидива.
1.4. Неправильно установленные энергетические параметры лазерного излучения. Отход от регламентированных режимов проведения ЭВЛО, желание «поэкспериментировать» с этими режимами, может обернуться недостаточно сильным прогревом интимы. Результатом этого будет или очень быстрая реканализация, или вообще полное отсутствие облитерации вены.
К «малым» тактическим ошибкам следует отнести:
1.5. Оставление притоков БПВ (МПВ) для отсроченного (три и более дня после ЭВЛО) удаления. В оставленных после устранения стволового рефлюкса притоках, по нашим наблюдениям, более чем в половине случаев на 4-8 сутки развивается локальный поверхностный тромбофлебит, на фоне которого не представляется возможным выполнить ни минифлебэктомию, ни склеротерапию. Кроме этого, такой тромбофлебит может существенно ухудшить качество жизни пациента.
Технические ошибки
К «большим» техническим ошибкам мы отнесли:
2.1. Повреждение БВ. Это может произойти при недостаточно чёткой визуализации торца световода при его позиционировании в зоне СФС. При этом может возникнуть термическое поражение одной из стенок БВ с развитием флеботромбоза. В одном известном нам случае повреждение ОБВ произошло из-за плохой визуализации рабочей части световода. При создании тумесцентной анестезии вместе с анестетиком в ткани зоны СФС был введён воздух. Так как воздух не проводит ультразвук, визуализация и позиционирование было выполнено не правильно и рабочая часть световода оказалась в ОБВ. Еще в одном случае повреждение ОБВ произошло из-за пренебрежения правилом двойного контроля позиционирования световода (ультразвуковой контроль и просвечиваемый под кожей пилотный луч). В обоих случаях развился пристеночный тромбоз ОБВ, без ТЭЛА. После консервативного лечения произошла полная реканализация.
2.2. Экстравазация световода и коагуляция подкожной клетчатки. Бывают ситуации, когда после перфорации стенки вены световод проскальзывает по стенке фасциального футляра БПВ (МПВ). При этом у хирурга может сохраниться ощущение такой же лёгкости и отсутствия препятствия при проведении световода, как будто бы он скользит внутри сосуда. Пилотный луч при этом также будет перемещаться к СФС, где в конечном итоге упрется в препятствие. Требуется очень внимательно производить позиционирование торца световода, разворачивая ультразвуковой датчик в разных плоскостях. В противном случаи будет коагулирована паравазальная клетчатка и оставлена интактной БПВ (МПВ).
2.3. Термическое повреждение окружающих тканей за счет недостаточной тумесцентной анестезии. Учитывая, что тепловое воздействие может передаваться из полости сосуда на паравазальные ткани, при недостаточной тумесцентной анестезии они могут повреждаться. Некоторые ткани, далеко отстоящие от вены, могут пребывать в состоянии парабиоза, т.е. могут восстановиться или некротизироваться в зависимости от ситуации. В последнем случаи возможно образование так называемых отсроченных некрозов, когда через довольно продолжительный период времени (1-3 недели) после ЭВЛО возникают некрозы кожи и подкожной жировой клетчатки по ходу коагулированой вены. В литературе описан случай повреждения наружной подвздошной артерии с образованием артерио-венозной фистулы после ЭВЛО (S.J. Ziporin et al., 2010).
2.4. Недостаточный прогрев вены (аппаратная или иная ошибка) не приводит к «закрытию вены», но через 4-6 дней возникает восходящий тромбофлебит БПВ. В этом случае, если на первом осмотре (обычно на 2-е сутки) вена не «закрылась», в просвет вены под УЗ-контролем вводится 3% этоксисклерол или фибро-вейн в виде пены, по стандартной методике стволовой эхо-контролируемой склеротерапии.
2.5. Оставление в просвете вены инородного тела. В литературе описаны случаи эмболии легочной артерии «отожжённой» частью катетера (Ларин С.И.,2008). Для исключения вероятности «отжечь» во время ЭВЛО часть катетера в просвете вены с развитием эмболии легочной артерии, мы практически отказались от использования катетеров для проведения световода внутри сосуда. В одном случае, когда был нарушен режим и повышена температура стерилизации световода, его полимерная оплётка под воздействием тепла отклеилась от стекловолокна и превратилась в тонкую и хрупкую трубочку. Часть этой оплётки отделилась от световода и осталась в вене. ТЭЛА не возникло, часть оплётки была выявлена при ультразвуковом контроле и удалена хирургически.
К «малым» техническим ошибкам мы отнесли:
2.6. Стремление произвести пункцию БПВ (МПВ) при выраженном спазме сосуда. Иногда при попытке его пунктировать, магистральный венозный ствол отвечает выраженным спазмом. Эта ситуация сразу становится отчетливо видна на экране ультразвукового сканера. В данном случае, после нескольких попыток следует перейти к венесекции с последующей катетеризацией вены ангиографическим катетером.
Наиболее вероятные тактические и технические ошибки, опасности осложнений, возникающие при выполнении ЭВЛО, сгруппированы и представлены в таблице 7.
Таблица 7. Тактические и технические ошибки при выполнении ЭВЛО, возникающие при этом осложнения и оптимальные тактические решения при их возникновении.
| «БОЛЬШИЕ» ТАКТИЧЕСКИЕ ОШИБКИ | ||
| Ошибки | Опасности и осложнения | Тактические решения |
| Расположение рабочего торца световода дистальнее, чем это необходимо. | Сохраняются проксимальные притоки БПВ (длинная культя), что значительно увеличивает риск возникновения рецидива. | При выявлении «длинной» культи выполнение склеротерапии притоков культи под ультразвуковым контролем или динамическое наблюдение с проведением склеротерапии при выявлении рефлюкса. |
| Ошибки | Опасности и осложнения | Тактические решения |
| Слишком проксимальная катетеризация БПВ (МПВ) с оставлением части ствола БПВ (МПВ) с несостоятельными клапанами | Сохранение участка ствола магистральной вены с несостоятельными клапанами, который может явиться источником рецидива. | На первом осмотре в сохранённый участок ствола под УЗ-контролем вводится 3% этоксисклерол или фибро-вейн в виде пены, по стандартной методике стволовой эхо-контролируемой склеротерапии |
| Неправильно установленные для данного случая параметры лазерного излучения или неадекватно большой для ЭВЛО калибр вены. | Не происходит «закрытие вены», но, тем не менее, через 4-7 дней возникают явления тромбофлебита БПВ (МПВ). Высокая вероятность реканализации. | Ежемесячный осмотр пациента с обязательным УЗАС вен, при первых признаках реканализации проводится склеротерапия или повторная ЭВЛО |
| «МАЛЫЕ» ТАКТИЧЕСКИЕ ОШИБКИ | ||
| Ошибки | Опасности и осложнения | Тактические решения |
| Оставление притоков БПВ (МПВ) для | Возникновение поверхностного | Компрессионное лечение трикотажем 2 класса |
| отсроченного (три и более дня после ЭВЛО) удаления. | тромбофлебита в неудалённых притоках БПВ (МПВ) приводит к невозможности выполнить их склеротерапию или минифлебэктомию. | компрессии, холод местно, НПВС в средне терапевтических дозах. |
| «БОЛЬШИЕ» ТЕХНИЧЕСКИЕ ОШИБКИ | ||
| Ошибки | Опасности и осложнения | Тактические решения |
| Введение рабочей части световода в БП | Возникновение тромботической окклюзии БВ, или, более вероятно, возникновение флотирующего тромба, фиксированного к одной из стенок БВ. | При тромбозе бедренной вены:
Экстренная госпитализация, низкомолекулярные гепарины, НПВС в терапевтических дозах, компрессионное лечение трикотажем 3 класса компрессии. |
| Экстравазация световода и коагуляция подкожной клетчатки | Остаётся полностью интактной БПВ (МПВ). | Повторное проведение ЭВЛО БПВ (МПВ). |
| Ошибки | Опасности и осложнения | Тактические решения |
| Термическое повреждение окружающих тканей за счет недостаточной тумесцентной анестезии | Образование некрозов кожи и подкожной клетчатки. Возможно повреждение магистральных сосудов и нервов. | Ведение образовавшейся раневой поверхности в соответствии с принципами лечения гнойных ран. При повреждении иных структур – лечение по обстоятельствам. |
| Недостаточный прогрев вены (аппаратная или иная ошибка) | Не происходит «закрытие вены», и через 4-7 дней возникает восходящий тромбофлебит БПВ (МПВ). «Закрытие» вены, тем не менее, происходит, но из-за недостаточного прогрева, в ней возникают явления тромбофлебита на 4-7 сутки. Высокая вероятность | Если на 2 – 3 сутки после ЭВЛО не определяется облитерации БПВ (МПВ), в этот же день проводится стволовая склеротерапия или повторная ЭВЛО. При появлении тромбофлебитических явлений в коагулированной вене: |
| реканализации. | лечение тромбофлебита. Ежемесячный осмотр пациента с УЗАС вен. При первых признаках реканализации проводится склеротерапия или повторная ЭВЛО. | |
| Оставление в просвете вены инородного тела | Возможна тромбоэмболия легочной артерии. | Немедленное удаление инородного тела. |
| «МАЛЫЕ» ТЕХНИЧЕСКИЕ ОШИБКИ | ||
| Ошибки | Опасности и осложнения | Тактические решения |
| Стремление произвести пункцию БПВ (МПВ) при выраженном спазме сосуда | На повторные пункции вена «отвечает» ещё более выраженным спазмом, что может привести к невозможности её пункции и сложностям даже при венесекции с заведением катетера. | После нескольких попыток следует перейти к венесекции с последующей катетеризацией вены ангиографическим катетером |
| Многократные попытки провести световод по БПВ при S-типе её расположения относительно поверхностной фасции на бедре. | Возможны перфорация БПВ и экстравазация световода | Использование ангиографического катетера или постановка второго световода выше изгиба вены. |
Глава 7. Особенности послеоперационного периода и оценка результатов эндовенозной лазерной облитерации в лечении варикозной болезни.
Особенности раннего послеоперационного периода.
Из 1825 пациентов, которым выполнялась ЭВЛО, 1561 проходили лечение амбулаторно во флебологическом центре, остальные 264 – в сосудистом отделении НМХЦ им. Н.И.Пирогова. Обе группы были сравнимы по полу, возрасту и клиническому классу заболевания. Летальных исходов не было.
После выполнения ЭВЛО и надевания компрессионного трикотажа, пациенту рекомендуется походить около 40 минут. Непрерывная (круглосуточная) компрессия показана до 5 суток. В дальнейшем пациент носит компрессионный трикотаж только в дневное время. Общая продолжительность ношения компрессионного трикотажа не превышает 1,5–2 месяцев. В первые сутки после ЭВЛО, пациенты предъявляют жалобы на неприятные ощущения вдоль коагулированной БПВ (МПВ). У 20,4% больных болевые ощущения требовали приёма обезболивающих препаратов (кеторол 10 мг однократно на ночь). Интенсивность болевых ощущений напрямую зависела от объёма выполненной операции (в основном за счет минифлебэктомии) и слабо коррелировала с длиной облитерированного ствола БПВ (МПВ).
Учитывая, что полная окклюзия БПВ (МПВ) после ЭВЛО возникает в течение 24 часов, первую перевязку мы выполняем, как правило, на вторые сутки после вмешательства. При этом удаляются пелоты, наложенные над местами удалённых или склерозированных притоков, а также вдоль ствола БПВ (МПВ). Обязательно выполняется ультразвуковое ангиосканирование с оценкой состояния сафено-феморального (сафенопоплитеального) соустья. При этом следует исключить переход тромба в бедренную (подколенную) вену. Оценивается состояние магистрального венозного ствола, где производилась ЭВЛО. Необходимо убедиться, что кровоток в вене отсутствует. Если при осмотре на 2–3 сутки после ЭВЛО не будет достигнуто эффекта, следует в этот же день провести повторную ЭВЛО или эхо-контролируемую склерооблитерацию. На этапе освоения нового оборудования, в трёх случаях не была достигнута полная облитерация БПВ. У одной пациентки на четвёртые сутки развился выраженный восходящий тромбофлебит коагулированной вены, потребовавший выполнения кроссэктомии. В двух других случаях была выполнена эхоконтролируемая склерооблитерация.
Состояние культи БПВ (МПВ) в этот срок отчётливо не определяется, так как вена тромбируется в проксимальной её части, за счёт резкого снижения объёмного кровотока на этом участке. Первые признаки реканализации этого участка могут возникнуть не ранее, чем через десять дней. Нередко, можно наблюдать пролабирование части тромба в бедренную или подколенную вену (рис.109б). Такое пролабирование, как правило, безопасно; роста тромба в проксимальном направлении мы не наблюдали ни в одном случае. Тем не менее, эта ситуация доставляет оперирующему хирургу неприятные переживания. Пролабирование тромба в глубокую вену наблюдается в тех случая, когда при позиционировании перед ЭВЛО рабочий торец световода подводится слишком проксимально.
У больных с редукционными типами расположения БПВ на бедре, в случае выполнения ЭВЛО притока, лежащего надфасциально, пальпаторно определяется уплотнение по ходу данного притока.

Рис. 109а. СПС 2-е сутки после ЭВЛО. Облитерация МПВ пристеночно к ПкВ.
Рис. 109б. СФС 2-е сутки после ЭВЛО. Не- значительное пролабирование тромба в ОБВ.
У большинства пациентов, в сроки от четвёртых до седьмых суток послеоперационного периода, развиваются выраженные в той или иной степени флебитические явления в коагулированной вене. Субъективно пациенты ощущают умеренную болезненность тянущего характера в проекции такой вены. В редких случаях отмечается кратковременный подъём температуры до 37–37,2°С. Необходимо отметить, что такие признаки не влияют на трудоспособность пациентов, основная часть которых продолжала трудиться в послеоперационном периоде. Поскольку сама технология ЭВЛО подразумевает развитие воспаления в коагулированной вене, то такое состояние следует расценивать как нормальные проявления послеоперационного периода. При этом выраженность этих явлений зависит от трёх факторов: плотности потока энергии во время процедуры ЭВЛО, наличия перфораций в облитерированной вене и близости расположения венозного ствола к коже.
Как уже упоминалось при описании технологии ЭВЛО, плотность потока энергии в венозном стволе должна быть адекватной. Наиболее выраженные явления флебита развиваются при минимальной плотности потока энергии. Если в данной ситуации не произвести повторное ЭВЛО или склеротерапию ствола БПВ (МПВ), то у данного пациента может развиться восходящий тромбофлебит с выраженными местными воспалительными явлениями. Выраженность флебита в послеоперационном периоде прямо коррелируют с плотностью энергии лазерного излучения. Чем выше эта плотность, тем менее выражены флебитические явления – и наоборот. Когда плотность потока энергии чрезмерна, возникают многочисленные перфорации и поражения паравазальных структур, которые увеличивают выраженность явлений перифлебита. При попадании крови в паравазальное пространство (например, при проколе вены иглой во время создания анестезии), в случае использования «гемоглобинпоглощаемых» лазеров, эта кровь поглощает световые потоки и разогревается с выделением газа. Это может вызывать выраженные воспалительные явления в послеоперационном периоде.
Плотный фасциальный футляр защищает БПВ и препятствует вовлечению кожи в воспалительные процессы. Тем не менее, существуют две ситуации, при которых это правило нарушается: во-первых, в нижней части бедра, где фасциальный футляр слабо выражен и, во-вторых, при редукционных типах расположения БПВ относительно фасции. Следует отметить, что кожа вовлекается в воспалительный процесс вторично, так как мощная водная прослойка, создаваемая во время тумесцентной анестезии, защищает её от теплового повреждения во время ЭВЛО.
У больных с редукционными типами расположения БПВ мы практически отказались от выполнения ЭВЛО надфасциально расположенного притока, так как при этом почти всегда возникают довольно выраженные явления флебита, и часто над таким притоком развиваются пигментации (рис.110). У некоторых больных мы выполняли эхо-склерооблитерацию надфасциального притока при редукционных типах расположения БПВ. Однако, при этом часто возникают и длительно существуют болезненные уплотнения на месте притока. Это явилось поводом отказа от склеротерапии в данной ситуации. Для такого анатомического варианта, с нашей точки зрения, оптимальным является удаление надфасциально расположенного притока методом минифлебэктомии (рис.111).

Рис. 110а. Пациент с s-типом расположения БПВ на 5-е сутки после ЭВЛО БПВ и над- фасциально расположенного притока. Выра- женные явления флебита.
Рис. 110б. Тот же пациент через 4 неде- ли после ЭВЛО БПВ и надфасциально расположенного притока. Сохраняется гиперпигментация над облитерирован- ным притоком.
Следующий контрольный осмотр пациента проводится через 2 недели. В эти сроки флебитические проявления исчезают. Часть пациентов отмечает чувство натяжения в месте расположения БПВ при максимальном разгибании конечности.

Рис. 111. Вид конечности перед ЭВЛО БПВ с s-типом расположения на бедре и спустя 2 месяца после операции.

Рис. 112. Гиперпигментации кожи, сохраняющиеся через 4 месяца после ЭВЛО БПВ совместно со склерооблитерацией притоков
При УЗАС оценивается состояние СФС (СПС), состояние облитерированной вены и крупных притоков, впадающие в неё. Появление реканализции через две недели после проведенной ЭВЛО свидетельствует о технических ошибках во время выполнения процедуры, приведших к уменьшению плотности потока энергии лазера в вене. Если в этот срок в БПВ (МПВ) или крупных притоках определяется кровоток, следует выполнить повторную ЭВЛО БПВ (МПВ) или склерооблитерацию притоков под контролем ультразвука. В случае, если ЭВЛО сочеталась со склеротерапией притоков, необходимо обязательно удалить коагулы из этих притоков. Если этого не выполнить, может появиться пигментация кожи (рис.112). Выявленная в эти сроки культя БПВ (МПВ) требует динамического наблюдения. Следует помнить, что сама по себе культя БПВ (МПВ) является рецидивом.
Ближайшие результаты ЭВЛО в срок через две недели после вмешательства представлены в таблице 8.
Таблица 8. Результаты через 2 недели после ЭВЛО, в зависимости от анатомического сегмента и клинического класса заболевания
| клиниче-
ский класс по СЕАР |
количество пол-
ных окклюзий БПВ |
количество полных
окклюзий МПВ |
количество полных окклюзий ПВ | |||
| абс. | % | абс. | % | абс. | % | |
| С2 | 1053 | 92,9 | 187 | 93,0 | 74 | 94,9 |
| С3 | 367 | 91,0 | 72 | 93,5 | 78 | 92,9 |
| С4 | 115 | 91,3 | 22 | 92,0 | 130 | 91,5 |
| С5 | 10 | 90,1 | 3 | 100,0 | 20 | 90,9 |
| С6 | 5 | 100,0 | 1 | 100,0 | 8 | 88,9 |
| Всего
(в среднем, %) |
1550 (93,0) | 285 (95,7) | 310 (91,8) | |||
Два месяца – стандартный срок ношения компрессионного трикотажа 2 класса компрессии после ЭВЛО. Жалоб в эти сроки пациенты, как правило, уже не предъявляют. При осмотре определяются лишь следы от проколов кожи после выполненной минифлебэктомии. При УЗАС оценивается состояние СФС (СПС) и наличие функционирующих притоков. Если определяются длинные идущие параллельно БПВ вены, имеющие кровоток, то  желательно выполнить их склерооблитерацию, даже при отсутствии рефлюкса в них, так как при сохранённой культе возникновение рефлюкса весьма вероятно. В этот срок окончательно становится ясным – произошла облитерация вен или нет. На рисунке 113 показана ультразвуковая картина приустьевого отдела БПВ в В-режиме. Отчетливо видно однородное заполнение вены гиперэхогенной формирующейся рубцовой тканью. Контуры вены неровные, нечёткие. Стенка вены не определяется.
желательно выполнить их склерооблитерацию, даже при отсутствии рефлюкса в них, так как при сохранённой культе возникновение рефлюкса весьма вероятно. В этот срок окончательно становится ясным – произошла облитерация вен или нет. На рисунке 113 показана ультразвуковая картина приустьевого отдела БПВ в В-режиме. Отчетливо видно однородное заполнение вены гиперэхогенной формирующейся рубцовой тканью. Контуры вены неровные, нечёткие. Стенка вены не определяется.
Рис. 113. Облитерированная БПВ через 2 месяца после ЭВЛО.
Особенности отдалённого периода после ЭВЛО
Отдалённые результаты ЭВЛО (в срок от 6 месяцев до 5 лет) приведены в таблице 9.
Таблица 9. Отдалённые результаты ЭВЛО
| Название вены | всего
осмотрено вен |
окклюзи-
рована, (%) |
реканализирована частично, (%) | полная река-
нализация, (%) |
восстановле-
ние рефлюса, (%) |
| БПВ | 1584 | 93,5 | 5,3 | 1,2 | 0,3 |
| МПВ | 275 | 96,8 | 2,8 | 0,4 | 0,1 |
| ПВ | 309 | 76,2 | 6,5 | 17,3 | 22,0 |

Рис. 114а. Два месяца после ЭВЛО. Культя БПВ не определяется.
Рис. 114б. Два месяца после ЭВЛО. Определяется культя БПВ с единственным притоком v.epigastrica superficialis.
При оценке отдалённых результатов ЭВЛО БПВ можно столкнуться с тремя вариантами состояния терминального отдела БПВ: полная облитерация БПВ у места впадения в ОБВ (рис. 114а), культя с единственным притоком v.epigastrica superficialis (рис.114б), длинная культя с наличием притоков (рис.115).

Рис. 115. Два месяца после ЭВЛО. Длинная культя БПВ.
Результаты, изображенные на рисунках 114а и 114б, свидетельствуют о низкой вероятности развития рецидива. Однако длинная культя, если она не имеет рефлюкса и не связана с варикозно расширенными притоками, ещё не является рецидивом. В случае возникновения рефлюкса в культе и связанных с ней притоках, выполняется ЭВЛО культи со склерооблитерацией притоков (22 наблюдения).

Рис. 116. Два месяца после ЭВЛО. Перфорантная вена облитерирована. Определяется кровоток в артерии перфорантного комплекса.
При правильно выполненной ЭВЛО перфорантных вен, как правило, сохраняется дееспособной артерия перфорантного комплекса (рис.116). Несомненно, данная артерия участвует в кровоснабжении сегмента конечности. Прецизионность ЭВЛО в устранении перфорантного сброса является существенным приоритетом перед открытой перевязкой и эндоскопической диссекцией.
Через 6 месяцев облитерированная вена уже практически не определяется (рис.117). В этот срок возможно развитие реканализаций в облитерированном венозном стволе. Как правило, это происходит в местах впадения крупных притоков (рис 118).
Реканализированные участки вен следует склерозировать вместе с притоками под ультразвуковым контролем.

Рис. 117. Шесть месяцев после ЭВЛО. БПВ практически не определяется.

Рис. 118. Шесть месяцев после ЭВЛО. Реканализация БПВ в месте впадения крупного притока
Повторные вмешательства были проведены 76-ти пациентам, которым мы ранее выполняли ЭВЛО на магистральных подкожных венах, что составило 4%. В этой группе больных в сроки до 6 месяцев возникли явления реканализации БПВ и МПВ. Всем пациентам производилась эхо-контролируемая склерооблитерация БПВ микропенной формой 3% этоксисклерола или фибро-вейна. Во всех случаях удалось добиться стойкой облитерации, сохраняющейся весь период наблюдения. У пациентов с реканализацией перфорантных вен был обнаружен достаточно высокий процент возобновления рефлюкса.

Рис. 119. Вид конечности до и через 6 месяцев после ЭВЛО БПВ и минифлебэктомии притоков.
Считая эхо-контролируемую склерооблитерацию недостаточно надёжным способом ликвидации перфорантного сброса, у 61-го больного (18%) мы провели повторную ЭВЛО перфорантов. При этом 7-ми пациентам ЭВЛО перфорантных вен пришлось провести трижды. Такой большой процент неудач объясняется недостаточной энергией лазерного излучения, используемого в первые годы применения метода. С тех пор, как мы стали использовать поток энергии не менее 300 Дж на точку в перфорантной вене (для 1030 нм), реканализации исчезли.
Существенным обстоятельством в оценке отдалённых результатов явилась ситуация, при которой ультразвуковой контроль в послеоперационном периоде позволил предотвратить появление истинных рецидивов, т.е. появления новых варикозно расширенных вен на оперированной конечности.
Повторные вмешательства были проведены 76-ти пациентам, которым мы ранее выполняли ЭВЛО на магистральных подкожных венах, что составило 4%. В этой группе больных в сроки до 6 месяцев возникли явления реканализации БПВ и МПВ. Всем пациентам производилась эхо-контролируемая склерооблитерация БПВ микропенной формой 3% этоксисклерола или фибро-вейна. Во всех случаях удалось добиться стойкой облитерации, сохраняющейся весь период наблюдения. У пациентов с реканализацией перфорантных вен был обнаружен достаточно высокий процент возобновления рефлюкса. Считая эхо-контролируемую склерооблитерацию недостаточно надёжным способом ликвидации перфорантного сброса, у 61-го больного (18%) мы провели повторную ЭВЛО перфорантов. При этом 7-ми пациентам ЭВЛО перфорантных вен пришлось провести трижды. Такой большой процент неудач объясняется недостаточной энергией лазерного излучения, используемого в первые годы применения метода. С тех пор, как мы стали использовать поток энергии не менее 300 Дж на точку в перфорантной вене (для 1030 нм), реканализации исчезли.
Существенным обстоятельством в оценке отдалённых результатов явилась ситуация, при которой ультразвуковой контроль в послеоперационном периоде позволил предотвратить появление истинных рецидивов, т.е. появления новых варикозно расширенных вен на оперированной конечности.
7.1. Перспективы развития ЭВЛО.
Основной вопрос, который подлежит обсуждению: сможет ли технология ЭВЛО в ближайшем будущем «отвоевать» себе часть территории у традиционной флебэктомии или ей уготована судьба многих других, модных в своё время, а ныне забытых методов?
Когда метод ЭВЛО впервые появился в лечении варикозной болезни, основным его преимуществом была практически 100% амбулаторность. Учитывая, что в Европе флебологи далеко не всегда являются врачами хирургических специальностей, появление метода, близкого по своей эффективности к традиционной флебэктомии, вызвало огромный интерес. Возможность выполнять полноценное устранение рефлюкса через прокол кожи, оказалось именно для стран Западной Европы очень важной особенностью метода. В России, сильной своими хирургическими традициями, ЭВЛО стала практически повсеместно выполняться в несколько видоизменённом варианте: а именно, как этап комбинированной флебэктомии, когда между операцией Троянова-Тренделенбурга и удалением притоков по Нарату выполнялось ЭВЛО БПВ (МПВ), как альтернатива удалению магистральной вены по Бэбкокку. Понятно, что в таких условиях метод может деградировать.
Тем не менее, ведущие медицинские центры России продолжали использовать эту технологию в «чистом» виде, что позволило накапливать клинический материал и постепенно переломить ситуацию. Благодаря многочисленным международным и отечественным конференциям, мастер-классам, проводимым Ассоциацией флебологов России, а также журналу «Флебология», где публиковались статьи, посвященные методике ЭВЛО, широкая хирургическая общественность страны приобщилась к передовому опыту применения ЭВЛО.
Уже во многих лечебных учреждениях России ЭВЛО стала основным методом в лечении варикозного расширения вен нижних конечностей. При этом вспомогательным методом часто становится эхоконтролируемая микропенная склерооблитерация, что позволяет минимизировать инвазивность вмешательства и значительно сократить время его выполнения.
Операции, выполняемые в условиях патологически изменённых тканей, несут повышенный риск раневых осложнений. Выполнение ЭВЛО под ультразвуковым контролем априорно лишает эту методику таких недостатков традиционных вмешательств, как избыточная травматичность при «слепом» поиске и удалении вен. Возможность выполнения ЭВЛО под местной анестезией в амбулаторных условиях имеет не меньшее значение, учитывая, что затраты на лечение возрастают пропорционально тяжести ХВН. Дополнительным преимуществом метода является возможность повторного и многократного его применения для достижения необходимого результата. При этом ЭВЛО становится минимально инвазивным методом коррекции гемодинамических нарушений и создаёт условия для повышения эффективности комплексного лечения. С широким внедрением в практику ЭВЛО тесно связано такое понятие, как этапность лечения. Практически любой объём вмешательства для уменьшения травматичности может быть разделен на этапы, каждый из которых может быть выполнен амбулаторно, минимально инвазивно и эстетично.
Если руководствоваться стандартным определением рецидива, как «появления варикозно расширенных вен на оперированной ранее конечности», сегодня, когда основным диагностическим методом является ультразвук, правильнее было бы вести речь о предпосылках к появлению рецидива. Возникающая после ЭВЛО реканализация магистральной вены не сразу приводит к появлению варикозно расширенных вен в её бассейне. Однако, при возникшем рефлюксе появление таких вен – дело времени. Поэтому повторные ЭВЛО этой вены или её склерооблитерацию следует назвать профилактикой рецидивов после ЭВЛО. Травматичность и риск повторной ЭВЛО не выше, чем при первичном вмешательстве, поэтому любой возникший патологический рефлюкс можно выявить на этапе отсутствия клинических его проявлений. Таким образом, современный подход к лечению варикозной болезни с использованием ЭВЛО немыслим без правильно организованной диспансеризации оперированных больных.
Функция венозной системы нижних конечностей заложена в её строении. Поэтому весьма вероятно, что атавистический вариант закладки вен в эмбриогенезе является структурной основой для возникновения и развития варикозной болезни. При таком взгляде на проблему, открываются новые перспективы в оценке риска возникновения ХЗВНК. Зная, какому анатомическому типу строения соответствует каждый из этих вариантов, будет возможно определить группу лиц с высоким риском возникновения патологии вен. Если, заглядывая в будущее, можно будет говорить о методах хирургической профилактики у лиц с высоким риском развития ХЗВНК, то предпочтение будет отдано минимально инвазивным технологиям, возможно и ЭВЛО.
Особое значение для работы имеет оборудование для ЭВЛО. На каком виде аппаратуры стоит остановить свой выбор? Какая длина волны предпочтительней – поглощаемая гемоглобином или водой? На основании собственного опыта мы можем констатировать, что и та, и другая длина волны имеет свои достоинства и недостатки. Метод ЭВЛО пока находится в стадии становления. В этой же стадии находятся и конкретные методики его использования — не до конца отработаны режимы, методы контроля, длина волны и т.п. Требуется ещё достаточно серьезная экспериментальная и клиническая работа.
Задача на ближайшее будущее состоит в четком разграничении показаний к применению различных типов лазеров (длин волн). Следует отказаться от стремления использовать лазер для лечения патологии, которую можно более эффективно лечить другими методами. Немотивированное расширение показаний к операции может только дискредитировать метод ЭВЛО. Однако, хотя мы и констатировали показания к ЭВЛО, это вовсе не означает, что они не могут быть пересмотрены. Вполне возможно, что уже в ближайшем будущем появятся новые режимы ЭВЛО или новое оборудование, что даст возможность успешно лечить ту патологию, которую мы сейчас относим к противопоказаниям. Наиболее перспективным в этом отношении нам представляется создание роботизированных комплексов с обратной связью, позволяющих максимально устранить влияние «человеческого фактора» во время операции ЭВЛО. Такие системы должны на всём протяжении вены автоматически подавать то количество энергии, которое требуется для успешной её облитерации, исключив возможность как интраоперационных осложнений, так и реканализаций. Задача хирурга при этом будет заключаться только во введении световода в вену и позиционировании рабочей его части, всё остальное аппарат выполнит сам. Работа по созданию такого роботизированного комплекса успешно ведётся сотрудниками НМХЦ им. Н.И.Пирогова и отечественного производителя лазерного оборудования ООО «Новые хирургические технологии». Мы уверены, что скоро он будет внедрён в клиническую практику.
В соответствии с приказом МЗ РФ от 19.05.1992 г. № 162 «О мерах по усилению контроля за разработкой и применением лазерной техники в медицине» к работе на лазерных аппаратах медицинский персонал допускается только после прохождения специализации по лазерной медицине. Эта специализация проводится в учебных учреждениях, получивших разрешение на её проведение и имеющих соответствующую лицензию. Головным учреждением по проблемам лазерной медицины в нашей стране является Государственный научный центр лазерной медицины. Иными словами, чтобы получить допуск для работы на лазерном оборудовании, специалист обязан пройти цикл усовершенствования в ГНЦ лазерной медицины. Поскольку ЭВЛО является достаточно узкой хирургической технологией, обучаться этому методу следует непосредственно в центрах, которые серьезно занимаются ЭВЛО и дают соответствующую подготовку. Учитывая возрастающий интерес врачей к этой методике, с 2010 года в Институте усовершенствования врачей Национального медико-хирургического центра им. Н.И.Пирогова организован цикл тематического усовершенствования «эндовенозная лазерная облитерация в лечении патологии хронических заболеваний вен нижних конечностей». Цикл даёт необходимый багаж теоретических знаний и практических навыков для самостоятельной работы.
Использование ультразвукового ангиосканирования становится главным диагностическим инструментом, поэтому успешное использование ЭВЛО невозможно без владения хирургом ультразвуковыми методами исследования. Описанные преимущества ЭВЛО создали условия для широкого внедрения этого метода, прежде всего, в амбулаторную практику.
Отсутствие необходимости пребывания в стационаре и практически неограниченная трудоспособность дают возможность «санировать» значительный контингент населения, большая часть из которого, прежде всего лица трудоспособного возраста, не имеет возможности «оторваться» от работы для лечения в стационаре.
Болевой синдром и развитие флебитических явлений в послеоперационном периоде являются одним из главных негативных впечатлений у пациентов, перенесших ЭВЛО. Несомненно, что переход на «водную» длину волны, а также другие технические усовершенствования помогут в будущем избавить пациентов от этих негативных проявлений. Необходимо создание стандартного протокола ЭВЛО, по мере накопления результатов фундаментальных исследований по взаимодействию лазерного излучения с живой тканью венозной стенки.
Конечно, в использовании ЭВЛО остаются свои технические и теоретические недоработки, поскольку прошёл слишком короткий период с начала его использования. Но всё это — только вопрос времени. Высокая косметичность вмешательства, отсутствие сколько-нибудь выраженного реабилитационного периода даёт право надеяться, что технология ЭВЛО займёт достойное место во флебологической практике.
Список основной литературы.
- Аскерханов Р. П. Хирургия периферических вен.— Махачкала, 1973.—392 с.
-
Атлас периферической нервной и венозной систем Под ред. В. Н. Шевкуненко.— М.: Медгиз, 1949. – 384 с.
-
Вальдман В. А. Венозное давление и венозный тонус.— 2-е изд., пере раб. и расш.— Л.: Медгиз, 1947.— 240 с.
-
Ванков В. Н. Строение вен.— М.: Медицина, 1974.— 207 с.
-
Васютков В. Я., Проценко Н. В. Трофические язвы голени и стопы.— М.: Медицина, 1993.— 160 с.
-
Веденский А. Н. Варикозная болезнь.- Л.: Медицина, 1983.—207 с.
-
Веденский А. Н. Посттромботическая болезнь.— Л.: Медицина, 1986.— 240 с.
-
Веденский А. Н., Лыткин М. И., Стойко Ю. М. и др. Ошибки, опас ности и осложнения в хирургии вен: Руководство для врачей / Под ред. Ю. Л. Шевченко.— СПб.: Питер, 1999.— 308 с.
-
Внутириутробное развитие человека: Руководство для врачей / Под ред. А. П. Милованова, С. В. Савельева.— М.: МДВ, 2006.— 284 с.Гессе Э. Р., Шаак В. А. Анатомо-функциональная и клиническая оценка операции сафено-бедренного анастомоза при варикозном расширении вен // Нов.хир.архив.— 1921.— № 1.— С. 123; № 2.— С. 222.
-
Гостищев В. К., Хохлов А. М. Патогенез трофических язв при вари козном расширении вен нижних конечностей // Хирургия.— 1991.— № 10.— С. 100—105.
-
Градусов Е. Г., Константинова Г. Д., Зубарев А. Р. и др. Склерооблите рация варикозных вен нижних конечностей под контролем ульт развуковых методов исследования // Ультразвуковая диагности ка.— 2000.—№ 3.—С. 121—126.
-
Гужков О. Н. Эндовазальная лазерная коагуляция в комплексном ле чении больных с варикозной болезнью вен нижних конечностей: Автореф. дис. … д-ра мед. наук.— М.,—2008. —32 с.
-
Дан В. Н., Сапелкин С. В. Ангиодисплазии (врожденные пороки раз вития сосудов).— М.: Вердана,2008.— 200 с.
-
Жуков Б. Н. Болезни периферических вен.— Самара: Дом печати, 1993.— 94 с.
-
Зубарев А. Р., Богачев В. Ю., Митьков В. В. Ультразвуковая диагно стика заболеваний вен нижних конечностей.— М.: Видар-М, 1999.— 100 с.
-
Игнатьев И. М., Бредихин Р. А., Ахметзянов Р. В. Метод интравазальной вальвулопластики при варикозной болезни // Флебология.— 2010.— Т. 4, № 1.— С. 15—20.
-
Кириенко А. И. Новые технологии лечения ХВН — что об этом дума ют специалисты?//Флеболимфология.— 2006.— № 27.— С.15.
-
Кириенко А. И., Богачев В. Ю., Золотухин И. А. Компрессионная склеротерапия (практическое руководство для врачей / Под ред. акад. РАН и РАМН В. С. Савельева.— М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН, 2004.— 40 с.
-
Константинова Г. Д. Практикум по лечению варикозной болезни.— М.: Профиль, 2006.— 191 с.
-
Ларин С. И. Случай эмболии легких инородным телом после выпол нения эндовазальной лазерной облитерации по поводу варикоз ной болезни // Флебология.— 2008.— Т.2, № 2.— С.64 – 65.
-
Назаренко Г. И., Кунгурцев В. В., Чиж В. Р. и др. Применение высо коэнергетического лазера в хирургическом лечении варикозной болезни // Ангиология и сосудистая хирургия.— 2001.— Т.7, № 4.— C.68.
-
Покровский А. В., Сапелкин С. В. Нуждается ли практическая флебо логия в классификации СЕАР? // Ангиология сегодня.— 1999.— № 6.— 9 – 13.
-
Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Утвер ждено совещанием экспертов 27.11.2009, Москва //Флебология.— 2010.— Т. 4, № 2.—С. 4—37.
-
Рохлин Д. Г. Болезни древних людей.—М.: Наука, 1965.— 304 с. Савельев В. С. Варикозная болезнь — современное состояние старой хирургической проблемы // Анналы хирургии.—1999.—№2. С. ы11—14.
-
Савельев В. С., Гологорский В. А., Кириенко А. И. Флебология: Руково дство для врачей/ Под ред. В. С. Савельева.— М.: Медицина, 2001.— 641 с.
-
Савельев В. С., Думпе Э. П., Яблоков Е. Г. Болезни магистральных вен.— М.: Медицина, 1972.— 440 с.
-
Фолков Б., Нил Э. Кровообращение: Пер с англ. —М.: Медицина, 1976.—463 с.
-
Швальб П. Г., Ухов Ю. И. Патология венозного возврата из нижних конечностей.— Рязань, 2009.— 152 с.
-
Шевченко Ю. Л., Стойко Ю. М., Мазайшвили К. В. Лазерная хирургия варикозной болезни.— М., 2010.— 195 с.
-
Шиманко А. И., Дибиров М. Д., Васильев А. Ю., Волков А. С. Примене ние лазера во флебологической практике //Материалы V конфе ренции ассоциации флебологов России.— М., 2004.—С. 348—349.
-
Шулутко А. М., Крылов А. Ю. Варикозная болезнь. Современные принципы лечения.— М.: Миклош, 2003.— 127 с.
-
Яблоков Е. Г., Кириенко А. И., Богачев В. Ю. Хроническая венозная недостаточность.— М.: Изд-во «Берег», 1999.— 128 с. Bergan J. J. The vein book. London, 2007.— 617 p. Blanchemaison Ph., Greney Ph., Camponovo J. Atlas d’anatomie des veines superficielles des membres infйrieurs.—Laboratoire Servier, s.d. vers, 1996.— 144 p.
-
Cavezzi A., Labropoulos N., Partsch H. et al. Duplex Ultrasound Investiga tion of the Veins in Chronic Venous Disease of the Lower Limbs—UIP Consensus Document. Part II. Anatomy //Eur. J. Vasc. Endovasc. Surg.— 2006.— N 31.— P. 288—299.
-
Dodd H., Cockett J. The pathology and surgery of the veins of the lower limb.—Edinburgh: Livingstone, 1976.— 462 p. Eklцf B. Revision of the CEAP classification. 10 years after its introduction in 1994 //Medicographia.— 2006.— Vol. 28, N 2.— P.175—180.
-
Handbook of venous disorders. 2nd ed. / Ed. by P. Gloviczki, J. S. T. Yao.— Hodder & Stoughton Educational, 2001. – 613 p.
-
Khilnani N. M., Grassi C. J., Kundu S. et al. Multi-society consensus qual ity improvement guidelines for the treatment of lower-extremity super ficial venous insufficiency with endovenous thermal ablation from the Society of Interventional Radiology // J. Vasc. Interv. Radiol.— 2010.— Vol.21, N 1.— P.14—31.
-
Lurie F., Kistner R. L., Eklof B., Kessler D. Mechanism of venous valve closure and role of the valve in circulation: a new concept // J. Vasc Surg. 1996.—Vol. 24, N 5.— P. 819—824.
-
Muller R. La phlebectomie ambulatoire // Phlebologie.— 1978.— Vol. 3.— P. 272—278.
-
Proebstle T. M., Lehr H. A., Kargl A. et al. Endovenous treatment of the greater saphenous vein with a 940-nm diode laser: thrombotic occlu sion after endoluminal thermal damage by laser-generated steam bub bles // J. Vasc Surg.— 2002.— Vol. 35, N 4.— P. 729—736.
-
Ramelet A.-A., Perrin M.., Kern P., Bounameaux H. Phlebology.— Elsevier Masson, 2008.— 566 p.Uhl J.-F., Gillot C. Embriology and three-dimensional anatomy of the su perficial venous system of the lower limbs //Phlebology.— 2007.— Vol. 22.— N.5.— P.194—206.

